Pulsatile Ausschüttung
Als pulsatile Ausschüttung (auch pulsatile Sekretion oder pulsatorische Ausschüttung) wird ein biochemisches Phänomen bezeichnet, das in einer Vielzahl an Zelltypen und Geweben stattfindet, wenn chemische Substanzen in einem regelmäßigen zeitlichen Muster ausgeschüttet werden. Meistens handelt es sich dabei um interzelluläre Signalisierungsmoleküle wie Hormone oder Neurotransmitter. Beispiele für Hormone, die pulsatil freigesetzt werden, sind Insulin, Thyreotropin, TRH, GnRH und Wachstumshormon. Im Nervensystem wird pulsatiles Verhalten z. B. in der oszillatorischen Aktivität zentraler Mustergeneratoren beobachtet. Im Herzen sind Schrittmacherzellen in der Lage zu pulsatiler Aktion und Sekretion.
Bei vielen Hormonen ist ein pulsatiles Sekretionsmuster von entscheidender Bedeutung für die Erhaltung einer kritischen homöostatischen Balance, die für wichtige Lebensprozesse, z. B. in der Ontogenese und Reproduktion, notwendig ist. Variationen der Konzentration mit einer bestimmten Frequenz können relevant für die Funktion von Hormonen sein. Ein Beispiel sind GnRH-Agonisten, die trotz ihrer agonistischen Wirkung zu einer funktionellen Hemmung durch Herabregulation des GnRH-Rezeptors als Folge der tonischen Stimulation führen. Eine der Funktionen der Pulsatilität dürfte daher in der Sensibilisierung der Zielgewebe für das betreffende Hormon durch Heraufregulation von Rezeptoren liegen.
Eine pulsatile Sekretion wird u. a. beobachtet bei:
Neuroendokrine Pulsatilität
Die wichtigsten Steuerungszentren der Hormonfreisetzung liegen im Hypothalamus, insbesondere im Nucleus paraventricularis und im Nucleus arcuatus.[1] Die zugehörigen Neurone projizieren zur Eminentia mediana, wo die von ihnen sezernieren Releasing-Hormone in ein Portalgefäßsystem, das den Hypothalamus mit der Hypophyse verbindet, sezerniert werden. In der Hypophyse stimulieren sie dann die Sekretion glandotroper Hormone.[1] Man nimmt an, dass die episodische Sekretion aus der Hypophyse durch eine ähnliche pulsatile Sekretion der zugehörigen Releasing-Hormone aus dem Hypothalamus synchronisiert wird. Dies wird gestützt durch neuere Untersuchungen, die beobachtet haben, dass die Sekretion der Hormone LH und FSH ähnlichen Mustern wie dem des hypothalamischen Releasing-Hormons GnRH unterliegt.[2][3]
Luteinisierendes und follikelstimulierendes Hormon (HPG-Achse)
Das luteinisierende Hormon (LH) und das follikelstimulierende Hormon (FSH) werden von der Hypophyse nach Stimulation durch GnRH aus dem Portalgefäßsystem freigesetzt.[4] Die pulsatile GnRH-Sekretion zieht eine pulsatile Freisetzung von FSH und LH nach sich, die im Rahmen von Regelkreisen geeignete Konzentrationen der biologischen wirksamen Geschlechtshormone wie Testosteron bei Männern oder Östradiol bei Frauen einstellen.[3]
ACTH und Glukokortikoide (HPA-Achse)
Auch Glukokortikoide, insbesondere Cortisol, werden in regelmäßigen Pulsen freigesetzt. Diese Pulse sind den bestehenden circadianen Rhythmen und der Freisetzung im Rahmen einer Stressantwort überlagert.[5][6] Die ultradianen Rhythmen der Cortisolfreisetzung unterliegen dabei einer hohen Frequenz, wobei die Ausschüttung amplitudenmoduliert wird.[5] Es wird angenommen, dass die beobachtete Pulsatiliät von Glukokortikoiden und des zugehörigen Steuerhormons ACTH durch eine pulsatile Sekretion des Releasing-Hormons CRH hervorgerufen wird, allerdings ist die Datenlage aufgrund der Schwierigkeit, die notwendigen Messungen durchzuführen, noch begrenzt.[5]
TSH und Schilddrüsenhormone (HPT-Achse)
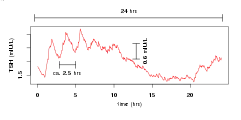
Das Sekretionsmuster des Thyreotropins (TSH) ist geprägt von infradianen, circadianen und ultradianen Rhythmen. Infradiane Rhythmen bilden sich insbesondere in einer circannualen Variation, welche die Saisonalität der Schilddrüsenfunktion widerspiegelt, ab.[7] Die zirkadianen Rhythmen sind von einer maximalen Sekretion (Akrophase) gegen Mitternacht und einer Nadir-Konzentration in der Mittagszeit und am frühen Nachmittag gekennzeichnet.[8][9] Ein ähnliches Muster zeichnet die Trijodthyronin- (T3-) Konzentration aus, allerdings ist hier die Phase verschoben.[9] Eine pulsatile Freisetzung trägt zum ultradianen Rhythmus der TSH-Konzentration mit ca. 10 Pulsen pro 24 Stunden bei.[10][11][12] Die Amplitude der circadianen und ultradianen TSH-Rhythmen ist bei schwerem Non-Thyroidal-Illness-Syndrom (TACITUS) reduziert.[13][14]
Nach neueren Theorien könnten autokrine und parakrine Rückkoppelungs-Mechanismen (Ultrashort Feedback) der TSH-Sekretion im Hypophysenvorderlappen eine entscheidende Rolle für die Genese der Pulsatilität spielen.[15][16][17]
Insulin

Auch Insulin wird pulsatil freigesetzt. Es wird angenommen, dass die ultradiane Rhythmik durch Oszillationen der intrazellulären Calciumkonzentration in den Betazellen des Pankreas hervorgerufen wird. Es wurde beobachtet, dass die Frequenz sekretorischer Pulse von Betazellen außerhalb von Langerhansschen Inseln sehr variabel ist (2 bis 10 Minuten). Innerhalb einer Insel synchronisieren sich die Betazellen dagegen über elektrische Koppelung durch Gap Junctions, so dass eine regelmäßigere Oszillationsfrequenz zwischen 3 und 6 Minuten entsteht. Die Koordination zwischen den Betazellen könnte darüber hinaus auch über ATP-Signalisierung erfolgen.[18] Auch α- und δ-Zellen im Pankreas sind zu einer pulsatilen Sekretion in der Lage.[19]
Einzelnachweise
- Eric R. Kandel, Thomas M. Jessell, James H. Schwartz, Steven A. Siegelbaum, A. J. Hudspeth: Principles of neural science, 5. Auflage 2013, ISBN 978-0-07-139011-8, OCLC 795553723.
- W. C. Wetsel, M. M. Valença, I. Merchenthaler, Z. Liposits, F. J. López, R. I. Weiner, P. L. Mellon, A. Negro-Vilar: Intrinsic pulsatile secretory activity of immortalized luteinizing hormone-releasing hormone-secreting neurons. In: Proceedings of the National Academy of Sciences of the United States of America. 89, Nr. 9, Mai 1992, S. 4149–4153. bibcode:1992PNAS...89.4149W. doi:10.1073/pnas.89.9.4149. PMID 1570341. PMC 525650 (freier Volltext).
- G. A. Stamatiades, U. B. Kaiser: Gonadotropin regulation by pulsatile GnRH: Signaling and gene expression. In: Molecular and Cellular Endocrinology. 463, März 2018, S. 131–141. doi:10.1016/j.mce.2017.10.015. PMID 29102564. PMC 5812824 (freier Volltext).
- Patricia E. Molina: Endocrine physiology, 5. Auflage 9. April 2018, ISBN 978-1-260-01936-0, OCLC 1026417940.
- Julia K. Gjerstad, Stafford L. Lightman, Francesca Spiga: Role of glucocorticoid negative feedback in the regulation of HPA axis pulsatility. In: Stress. 21, Nr. 5, September 2018, S. 403–416. doi:10.1080/10253890.2018.1470238. PMID 29764284. PMC 6220752 (freier Volltext).
- A. Kalsbeek, R. van der Spek, J. Lei, E. Endert, R. M. Buijs, E. Fliers: Circadian rhythms in the hypothalamo-pituitary-adrenal (HPA) axis. In: Molecular and Cellular Endocrinology. 349, Nr. 1, Februar 2012, S. 20–29. doi:10.1016/j.mce.2011.06.042. PMID 21782883.
- A. Tendler, A. Bar, N. Mendelsohn-Cohen, O. Karin, Y. Korem Kohanim, L. Maimon, T. Milo, M. Raz, A. Mayo, A. Tanay, U. Alon: Hormone seasonality in medical records suggests circannual endocrine circuits.. In: Proceedings of the National Academy of Sciences of the United States of America. 118, Nr. 7, 16. Februar 2021. doi:10.1073/pnas.2003926118. PMID 33531344.
- C. Lucke, R. Hehrmann, K. von Mayersbach, A. von zur Mühlen: Studies on circadian variations of plasma TSH, thyroxine and triiodothyronine in man.. In: Acta endocrinologica. 86, Nr. 1, September 1977, S. 81–88. doi:10.1530/acta.0.0860081. PMID 578614.
- W. Russell, R. F. Harrison, N. Smith, K. Darzy, S. Shalet, A. P. Weetman, R. J. Ross: Free triiodothyronine has a distinct circadian rhythm that is delayed but parallels thyrotropin levels.. In: The Journal of clinical endocrinology and metabolism. 93, Nr. 6, Juni 2008, S. 2300–2306. doi:10.1210/jc.2007-2674. PMID 18364382.
- S. L. Greenspan, A. Klibanski, D. Schoenfeld, E. C. Ridgway: Pulsatile secretion of thyrotropin in man.. In: The Journal of clinical endocrinology and metabolism. 63, Nr. 3, September 1986, S. 661–668. doi:10.1210/jcem-63-3-661. PMID 3734036.
- G. Brabant, K. Prank, U. Ranft, T. Schuermeyer, T. O. Wagner, H. Hauser, B. Kummer, H. Feistner, R. D. Hesch, A. von zur Mühlen: Physiological regulation of circadian and pulsatile thyrotropin secretion in normal man and woman.. In: The Journal of clinical endocrinology and metabolism. 70, Nr. 2, Februar 1990, S. 403–409. doi:10.1210/jcem-70-2-403. PMID 2105332.
- M. H. Samuels, J. D. Veldhuis, P. Henry, E. C. Ridgway: Pathophysiology of pulsatile and copulsatile release of thyroid-stimulating hormone, luteinizing hormone, follicle-stimulating hormone, and alpha-subunit.. In: The Journal of clinical endocrinology and metabolism. 71, Nr. 2, August 1990, S. 425–432. doi:10.1210/jcem-71-2-425. PMID 1696277.
- R. Adriaanse, J. A. Romijn, G. Brabant, E. Endert, W. M. Wiersinga: Pulsatile thyrotropin secretion in nonthyroidal illness.. In: The Journal of clinical endocrinology and metabolism. 77, Nr. 5, November 1993, S. 1313–1317. doi:10.1210/jcem.77.5.8077326. PMID 8077326.
- A. Chatzitomaris, R. Hoermann, J. E. Midgley, S. Hering, A. Urban, B. Dietrich, A. Abood, H. H. Klein, J. W. Dietrich: Thyroid Allostasis-Adaptive Responses of Thyrotropic Feedback Control to Conditions of Strain, Stress, and Developmental Programming.. In: Frontiers in endocrinology. 8, 2017, S. 163. doi:10.3389/fendo.2017.00163. PMID 28775711.
- J. W. Dietrich, A. Tesche, C. R. Pickardt, U. Mitzdorf: Thyrotropic Feedback Control: Evidence for an Additional Ultrashort Feedback Loop from Fractal Analysis. In: Cybernetics and Systems. 35, Nr. 4, Juni 2004, S. 315–331. doi:10.1080/01969720490443354.
- J. W. Dietrich, G. Landgrafe, E. H. Fotiadou: TSH and Thyrotropic Agonists: Key Actors in Thyroid Homeostasis.. In: Journal of thyroid research. 2012, 2012, S. 351864. doi:10.1155/2012/351864. PMID 23365787.
- R. Hoermann, J. E. Midgley, R. Larisch, J. W. Dietrich: Homeostatic Control of the Thyroid-Pituitary Axis: Perspectives for Diagnosis and Treatment.. In: Frontiers in endocrinology. 6, 2015, S. 177. doi:10.3389/fendo.2015.00177. PMID 26635726.
- B. Hellman, E. Gylfe, E. Grapengiesser, H. Dansk, A. Salehi: Insulinoscillationer – en kliniskt betydelsefull rytmik. Diabetesläkemedel bör öka den pulsatila komponenten av insulinfrisättningen. In: Lakartidningen. 104, Nr. 32–33, August 2007, S. 2236–2239. PMID 17822201.
- B. Hellman: Pulsatility of insulin release – a clinically important phenomenon. In: Upsala Journal of Medical Sciences. 114, Nr. 4, 2009, S. 193–205. doi:10.3109/03009730903366075. PMID 19961265. PMC 2852781 (freier Volltext).