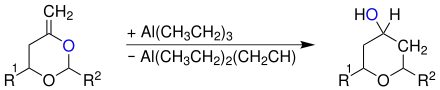Petasis-Ferrier-Umlagerung
Die Petasis-Ferrier-Umlagerung ist eine Namensreaktion aus dem Bereich der Organischen Chemie, die 1995 durch den zypriotischen Chemiker Nicos A. Petasis publiziert wurde.[1] Die Petasis-Ferrier-Umlagerung beschreibt die Umsetzung eines Enolacetals unter Einwirkung einer Lewissäure in ein Tetrahydropyranon.[2]
Übersicht
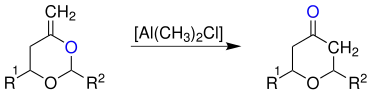
Ein Enolacetal, hier mit einem sechsgliedrigen Heterocyclus (R1, R2 = Alkyl-, Arylrest), wird, katalysiert von einer Lewissäure, hier Dimethylaluminiumchlorid, in ein Tetrahydropyranon umgesetzt:[3]
Es findet eine Umlagerung statt, wobei aus einem Acetalsauerstoffatom (blau markiert) das Sauerstoffatom der Carbonylgruppe eines Ketons wird.[3]
Außerdem können auch die Lewissäuren Bortrifluorid (BF3), Zinkchlorid (ZnCl2), TiCl2(O-i-Pr)2 und Monomethylaluminiumdichlorid (AlCH3Cl2) verwendet werden.[4]
Alternativ kann ein gleiches Enolacetal (R1, R2 = Alkyl-, Arylrest) mit einem Trialkylaluminium, hier Triethylaluminium, zu einem Tetrahydropyranol umgesetzt werden:[5]
Wird Dimethylaluminiumchlorid als Lewissäure verwendet, erfolgt die Umsetzung ausschließlich zum Tetrahydropyranon und nicht zum Tetrahydropyranol.[5]
Reaktionsmechanismus
Die nachfolgende Darstellung beschreibt einen Vorschlag für den Reaktionsmechanismus am Beispiel von 2,4-Dimethyl-6-methylen-1,3-dioxan:[3]

Das 2,4-Dimethyl-6-methylen-1,3-dioxan (1) wird durch Addition der Lewissäure Dimethylaluminiumchlorid zu (E)-Chlor((4-(ethylidenoxonio)pent-1-en-2-yl)oxy)dimethylaluminat (2) umgesetzt. Nach der Abspaltung des Dimethylaluminiumchlorids entsteht schließlich das 2,6-Dimethyltetrahydro-4H-pyran-4-on (3).[3]
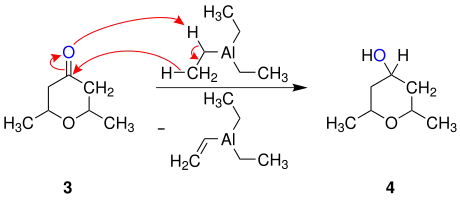
Wird das 2,6-Dimethyltetrahydro-4H-pyran-4-on (3) anschließend durch ein Trialkylaluminium – hier Triethylaluminium – reduziert, entsteht das 2,6-Dimethyltetrahydro-2H-pyran-4-ol (4).[5]
Stereoselektivität
Die Petasis-Ferrier-Umlagerung läuft bei Verwendung eines chiralen Enolacetals als Edukt mit hoher Stereoselektivität ab. Die Stereoselektivität des letzten Schritts, der Reduktion des Tetrahydropyranons (bzw. Tetrahydrofuranons), hängt von der Wahl der Lewissäure ab. Es ist ein Trialkylaluminium nötig, damit die Reduktion ablaufen kann, bei der Verwendung von Dimethylaluminiumchlorid läuft die Reduktion beispielsweise nicht ab.[5]
Anwendungsbeispiele
Ein Beispiel für eine Syntheseanwendung stellt die Darstellung eines C3-C19 Zwischenproduktes für die Herstellung von (+)-Phorboxazol A dar:
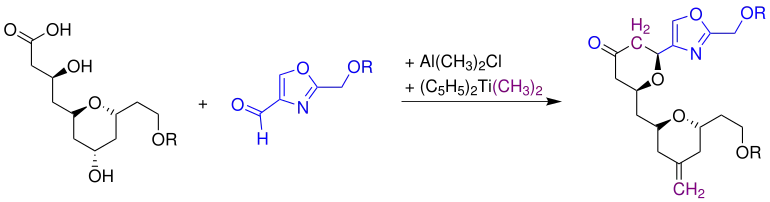
Das substituierte Tetrahydropyran wird mit einem 2-(Alkoxymethyl)oxazol-4-carbaldehyd, Dimethylaluminiumchlorid und der Petasis-Reagenz zu dem C3-C19 Zwischenprodukt für die Herstellung von (+)-Phorboxazol A umgesetzt. Dabei entsteht ausschließlich dieses Isomer des C3-C19 Zwischenproduktes von (+)-Phorboxazol A.[5]
Einzelnachweise
- N. A. Petasis, S.-P. Lu, J. Am. Chem. Soc., 1995, Vol. 117, S. 6394.
- A. B. Smith, K. P. Minbiole, P. R. Verhoest, M. Schelhaas, J. Am. Chem. Soc., 2001, Vol. 123, S. 10942.
- Z. Wang (Hrsg.): Comprehensive Organic Name Reactions and Reagents, 3 Volume Set, John Wiley & Sons, Hoboken, New Jersey, 2009, ISBN 978-0-471-70450-8, S. 2173–2174.
- A. B. Smith, P. R. Berhoest, K. P. Minbiole, J. J. Lim, Org. Lett., 1999, Vol. 1, S. 909.
- László Kürti und Barbara Czakó: Strategic Applications of Named Reactions in Organic Synthesis: Background and Detailed Mechanisms, Elsevier Academic Press, 2005, S. 342–343, ISBN 978-0-12-429785-2.