Pertuzumab
Pertuzumab (auch bekannt als 2C4, Omnitarg, Handelsname Perjeta, Hersteller Genentech/Roche) ist ein monoklonaler Antikörper, der in der Behandlung von HER2-positivem Brustkrebs zusammen mit Trastuzumab und Docetaxel eingesetzt wird.[1][2]
| Pertuzumab | ||
|---|---|---|
 | ||
| Bezeichner | ||
| Externe IDs |
| |
| Arzneistoffangaben | ||
| ATC-Code | L01XC13 | |
| DrugBank | DB06366 | |
| Wirkstoffklasse | Zytostatikum, Monoklonaler Antikörper | |
Geschichte
Perjeta wurde durch Genentech entwickelt. Die Zulassung zur Behandlung von HER2-positivem metastatischem Brustkrebs erfolgte durch die amerikanische Gesundheitsbehörde FDA im Juni 2012.[3] 2013 erfolgte dann die Zulassung in Europa durch die Europäische Arzneimittel-Agentur EMA.[4]
Wirkungsbereich
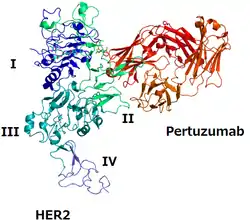
Die HER-Familie von transmembranen Rezeptor-Tyrosinkinasen und im Speziellen HER2 wurden als wichtiges Ziel in der Bekämpfung von Brustkrebs identifiziert.[5] Die Signalübertragung durch HER spielt insbesondere im Tumorwachstum sowie in der Differenzierung der Zelle eine wesentliche Rolle.[5] Der rekombinante humanisierte monoklonale Antikörper Pertuzumab bindet spezifisch an die extrazelluläre Dimerisierungsdomäne (Subdomäne II) des Wachstumsfaktorrezeptorproteins HER2.[6] Dabei wird auch die Heterodimerisierung mit anderen Rezeptoren (z. B. HER3 und HER4) gehemmt.[6] Dies soll das Wachstum des Tumors verhindern.[7] Zusätzlich ist Pertuzumab auch ein Mediator für antikörperabhängige zellvermittelte Zytotoxizität (engl. ADCC, antibody dependent cellular cytotoxicity).[6]
Verabreichung
Am Beginn der Therapie werden 840 mg Pertuzumab zusammen mit 8 mg/kg Trastuzumab und 75 mg/m2 Docetaxel verabreicht. Nach jeweils drei Wochen erfolgt die weitere Gabe von 420 mg Pertuzumab zusammen mit 6 mg/kg Trastuzumab und 75 oder 100 mg/m2 Docetaxel.[1][8]
Nebenwirkungen
In den klinischen Studien wurden unter anderem Neutropenie, Schlaflosigkeit, Appetitlosigkeit, Diarrhoe oder Erbrechen als Nebenwirkungen festgestellt.[6]
Klinische Studien
Die Verabreichung von Pertuzumab zusammen mit Trastuzumab und Docetaxel zeigte ein signifikant verlängertes progressionsfreies Überleben in der multinationalen klinischen Phase-III-Studie CLEOPATRA.[9] In weiteren aktuell laufenden klinischen Studien MARIANNE (fortgeschrittener Brustkrebs), NEOSPHERE (Brustkrebs im Anfangsstadium) und TRYPHAENA (HER2-positiver Brustkrebs im Stadium II/III) wird Pertuzumab an Patientinnen evaluiert.[10]
Siehe auch
Nomenklatur der monoklonalen Antikörper, Konvention zur Benennung von monoklonalen Antikörpern
Weblinks
- Videoclip über die Funktionsweise von Pertuzumab auf der Videoplattform YouTube (englisch)
- Öffentlicher Beurteilungsbericht (EPAR) der europäischen Arzneimittelagentur (EMA) zu: Pertuzumab
Einzelnachweise
- Highlights of prescribing information. Genentech, abgerufen am 25. Juni 2014.
- Data From Omnitarg Clinical Program Presented at American Society of Clinical Oncology Meeting. Genentech, archiviert vom Original am 13. Juli 2014; abgerufen am 28. Juni 2014.
- FDA Approves Perjeta (Pertuzumab) for People With HER2-Positive Metastatic Breast Cancer. Genentech, abgerufen am 9. Juni 2012.
- Roche erhält EU-Zulassung für PERJETA, eine neue personalisierte Therapie für aggressive Form von Brustkrebs. Roche, archiviert vom Original am 3. Oktober 2013; abgerufen am 26. Juni 2014.
- Pertuzumab – Treatment / Therapy for Breast Cancer. drugdevelopment-technology.com, abgerufen am 26. Juni 2014.
- Zusammenfassung der Merkmale des Arzneimittels. EMA, abgerufen am 25. Juni 2014.
- J. S. de Bono, J. Bellmunt, G. Attard, J. P. Droz, K. Miller, A. Flechon, C. Sternberg, C. Parker, G. Zugmaier, V. Hersberger-Gimenez, L. Cockey, M. Mason, J. Graham: Open-label phase II study evaluating the efficacy and safety of two doses of pertuzumab in castrate chemotherapy-naive patients with hormone-refractory prostate cancer. In: Journal of clinical oncology : official journal of the American Society of Clinical Oncology. Band 25, Nummer 3, Januar 2007, S. 257–262, doi:10.1200/JCO.2006.07.0888. PMID 17235043.
- Pertuzumab. Drugs.com, abgerufen am 26. Juni 2014.
- J. Baselga, J. Cortés, S. B. Kim, S. A. Im, R. Hegg, Y. H. Im, L. Roman, J. L. Pedrini, T. Pienkowski, A. Knott, E. Clark, M. C. Benyunes, G. Ross, S. M. Swain: Pertuzumab plus trastuzumab plus docetaxel for metastatic breast cancer. In: The New England Journal of Medicine. Band 366, Nummer 2, Januar 2012, S. 109–119, doi:10.1056/NEJMoa1113216, PMID 22149875.
- Keating GM. Pertuzumab: in the first-line treatment of HER2-positive metastatic breast cancer. In: Drugs 2012 Feb 12; 72 (3): 353-360.