Peroxosalpetersäure
Die Peroxosalpetersäure ist eine Sauerstoffsäure des Stickstoffs mit der Summenformel NO2(OOH) = HNO4. Die sehr unbeständige Verbindung wird zu den Photooxidantien gezählt.[2]
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
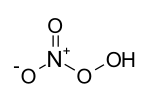 | |||||||||||||
| Allgemeines | |||||||||||||
| Name | Peroxosalpetersäure | ||||||||||||
| Andere Namen |
Peroxysalpetersäure | ||||||||||||
| Summenformel | HNO4 | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 79,01 g·mol−1 | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Herstellung
Peroxosalpetersäure lässt sich im Labor durch Einwirkung von trockenem Wasserstoffperoxid (H2O2) auf kristallines Distickstoffpentoxid (N2O5, das Anhydrid der Salpetersäure) bei einer Temperatur von −80 °C herstellen:[2]
Aufgrund ihrer hohen Instabilität zerfällt sie bereits bei −30 °C explosionsartig.[3] Als schwach konzentrierte Lösung ist sie bei 20 °C für einige Zeit haltbar, zerfällt dann jedoch in H2O2 und HNO3. Bei pH-Werten > 5 zerfällt das Peroxonitration in ein Nitrit-Ion und ein Sauerstoffmolekül:
Auftreten in der Natur
In der Erdatmosphäre kann es durch intensive Sonneneinstrahlung zur (kurzfristigen) Bildung von Peroxosalpetersäure durch Reaktion von Stickstoffdioxid (NO2) mit einem HOO·-Radikal kommen:[4]
Aufgrund ihrer Instabilität zerfällt sie auch wiederum und reagiert unter anderem zu den oben beschrieben Produkten.
Einzelnachweise
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- Ralf Steudel: Chemie der Nichtmetalle Von Struktur und Bindung zur Anwendung. Walter de Gruyter, 2008, ISBN 978-3-11-021128-3, S. 350 (eingeschränkte Vorschau in der Google-Buchsuche).
- Erwin Riedel, Christoph Janiak: Anorganische Chemie. Walter de Gruyter, 2011, ISBN 978-3-11-022566-2, S. 485 (eingeschränkte Vorschau in der Google-Buchsuche).
- Detlev Möller: Luft Chemie, Physik, Biologie, Reinhaltung, Recht. Walter de Gruyter, 2003, ISBN 978-3-11-016431-2, S. 355 (eingeschränkte Vorschau in der Google-Buchsuche).