Peroxiredoxin
Peroxiredoxin (ausführlich nach IUBMB: thiol-containing-reductant:hydroperoxide oxidoreductase) ist ein Enzym, das in allen Lebewesen vorkommt. Im reduzierten Zustand katalysiert es die Reduktion von Hydroperoxiden (R-OOH) zum entsprechenden Alkohol (R-OH), wobei es selbst an einem Cysteinrest oxidiert wird; in einem zweiten Schritt wird der ursprüngliche Zustand über die gleichzeitige Oxidation eines Thiols, meistens Thioredoxin, wiederhergestellt. Hydroperoxide sind schädliche Nebenprodukte der Sauerstoffatmung und zählen zu den reaktiven Sauerstoffspezies; reduziertes Peroxiredoxin wirkt daher als Antioxidans. Beim Menschen sind sechs verschiedene Peroxiredoxine bekannt, die von den Genen PRDX1 bis PRDX6 codiert werden, zwischen etwa 200 und 270 Aminosäuren aufweisen und sowohl als Monomer, Dimer oder Oligomer auftreten können.[2][3]
| Peroxiredoxin | ||
|---|---|---|
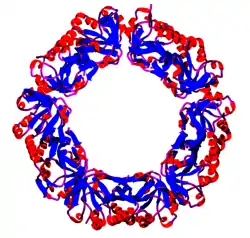 | ||
| Dekamer des AhpC aus Salmonella typhimurium, ein bakterielles Peroxiredoxin -- nach PDB 1YEX | ||
| Enzymklassifikation | ||
| EC, Kategorie | 1.11.1.15, Oxidoreduktase | |
| Reaktionsart | Redoxreaktion | |
| Substrat | R-OOH (+Enzym-Cys) | |
| Produkte | R-OH (+Enzym-Cys-OH) | |
| Vorkommen | ||
| Übergeordnetes Taxon | Lebewesen[1] | |
Katalysierte Reaktion
Zunächst wird das Hydroperoxid reduziert, mit gleichzeitiger Oxidation des Peroxiredoxin. Im Detail ergibt sich in einem speziellen Cysteinrest des Peroxiredoxins eine Sulfensäure, die sich mit einem weiteren Cysteinrest (der sich in demselben Polypeptid oder dem Dimer-Partner befindet) unter Wasserabspaltung zu einer Cys-S-S-Cys Disulfidbrücke verbindet.
Später wird Peroxiredoxin mit Thioredoxin zurückreduziert, genauer gesagt wird das Disulfid zum Dithiol reduziert. Die nötigen Wasserstoffatome stammen vom Dithiol des Thioredoxins, das seinerseits nach der Oxidation eine Disulfidbrücke aufweist.[4]