Palladium(II)-sulfat
Palladium(II)-sulfat ist eine anorganische chemische Verbindung des Palladiums aus der Gruppe der Sulfate.
| Kristallstruktur | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
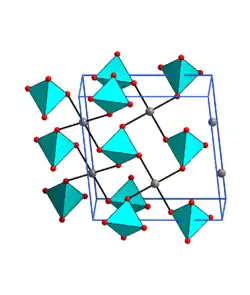 | ||||||||||||||||
| _ Pd2+ _ O2− | ||||||||||||||||
| Kristallsystem | ||||||||||||||||
| Raumgruppe |
C2/c (Nr. 15) | |||||||||||||||
| Gitterparameter | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Palladium(II)-sulfat | |||||||||||||||
| Andere Namen |
Palladiumsulfat | |||||||||||||||
| Verhältnisformel | PdSO4 | |||||||||||||||
| Kurzbeschreibung |
rotbrauner Feststoff[2] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 202,48 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest[2] | |||||||||||||||
| Siedepunkt |
330 °C[2] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Gewinnung und Darstellung
Palladium(II)-sulfat-hydrat kann durch Reaktion von Palladium(II)-nitrat mit Schwefelsäure bei 80 °C gewonnen werden. Durch Umsetzung des Hydrates mit konzentrierter Schwefelsäure bei 250 °C lässt sich das Anhydrat gewinnen.[3]
Eigenschaften
Palladium(II)-sulfat ist ein rotbrauner Feststoff,[2] der in Wasser hydrolysiert und in verdünnter Schwefelsäure schlecht löslich ist.[3] Der Kristallstruktur ist monoklin in der Raumgruppe C2/c (Raumgruppen-Nr. 15). Hierbei ist jedes Palladiumatom quadratisch-planar von vier Sulfationen koordiniert, die ihrerseits an drei weitere Palladiumatome gebunden sind.[1]
Einzelnachweise
- T. Dahmen, P. Rittner, S. Böger-Seidl, R. Gruehn: Beiträge zum thermischen Verhalten von Sulfaten. XIV. Zum thermischen Verhalten von PdSO4·2 H2O und PdSO4·0,75 H2O sowie zur Struktur von M-PdSO4. In: Journal of Alloys and Compounds, 1994, 216, S. 11–19 doi:10.1016/0925-8388(94)91034-0
- Datenblatt Palladium(II) sulfat, 98% bei Sigma-Aldrich, abgerufen am 1. September 2013 (PDF).
- Georg Brauer (Hrsg.) u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band III, Ferdinand Enke, Stuttgart 1981, ISBN 3-432-87823-0, S. 1731.
