Oximether
Oximether (gesprochen: Oxim-ether) sind organische chemische Verbindungen, die sich von den Oximen mit der funktionellen Gruppe C=N–OH ableiten, indem das Wasserstoffatom der Hydroxygruppe durch einen Alkylrest substituiert ist.
Herstellung
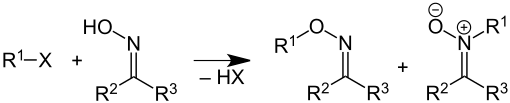
Oximether werden aus Oximen (Aldoximen oder Ketoximen) und Halogenalkanen oder Alkylsulfaten synthetisiert.[1] Als Nebenprodukte bilden sich durch N-Alkylierung Nitrone. Die relative Ausbeute an gebildetem Oximether und Nitron hängt von den Reaktionsbedingungen und Reagenzien ab. So bilden anti-Benzaloxim (Oxim des Benzaldehyds) vorwiegend Nitrone, während das syn-Isomer vorwiegend zum Oximether reagiert.[2]
Wenn man Silbersalze von Oximen mit Alkyliodiden in Ether oder Alkohol umsetzt, erhält man fast ausschließlich Oximether, Nitrone entstehen dabei nicht.[3] Bei der Umsetzung von Aldoximen mit Diazomethan als Methylierungsmittel erhält man Gemische aus O-Methyloximen und Methylnitronen.[4] Aus Oximen und Oxiranen erhält man unter Öffnung das Oxiran-Ringes O-(2-Hydroxyalkyl)-oxime.[5]
Einzelnachweise
- Jerry March: Advanced Organic Chemistry, Wiley, 3. Auflage (1985), S. 359, ISBN 0-471-85472-7.
- Buchler, J. Org. Chem. 32 (1967) 261.
- Horst Metzger: Herstellung und Umwandlung von Oximen in Houben-Weyl (Herausgeber: Eugen Müller, Otto Bayer, Hans Meerwein und Karl Ziegler): Methoden der Organischen Chemie, Band X/4, Stickstoffverbindungen I, Teil 4, 1968, S. 1–308, dort S. 219–220.
- Horst Metzger: Herstellung und Umwandlung von Oximen in Houben-Weyl (Herausgeber: Eugen Müller, Otto Bayer, Hans Meerwein und Karl Ziegler): Methoden der Organischen Chemie, Band X/4, Stickstoffverbindungen I, Teil 4, 1968, S. 1–308, dort S. 223.
- Horst Metzger: Herstellung und Umwandlung von Oximen in Houben-Weyl (Herausgeber: Eugen Müller, Otto Bayer, Hans Meerwein und Karl Ziegler): Methoden der Organischen Chemie, Band X/4, Stickstoffverbindungen I, Teil 4, 1968, S. 1–308, dort S. 224.