Lithiumselenid
Lithiumselenid, Li2Se, ist eine chemische Verbindung des Lithiums aus der Gruppe der Selenide.
| Kristallstruktur | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
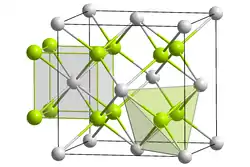 | |||||||||||||||||||
| _ Li+ _ Se2− | |||||||||||||||||||
| Kristallsystem | |||||||||||||||||||
| Raumgruppe |
Fm3m (Nr. 225) | ||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Lithiumselenid | ||||||||||||||||||
| Andere Namen |
Dilithiumselenid | ||||||||||||||||||
| Verhältnisformel | Li2Se | ||||||||||||||||||
| Kurzbeschreibung |
rotbrauner Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 92,84 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte |
2,91 g·cm−3[1] | ||||||||||||||||||
| Löslichkeit |
löslich in Wasser[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Gewinnung
Lithiumselenid kann durch Reaktion von Selen mit Lithium gewonnen werden. Die Reaktion findet in flüssigem Ammoniak statt. Nach Verdampfung des Ammoniaks bleibt das rotbraune Lithiumselenid zurück.[1]
Eigenschaften
Dilithiumselenid kristallisiert in einem kubischem Kristallsystem. Es besitzt wie die anderen Lithiumchalkogenide die Raumgruppe Fm3m (Raumgruppen-Nr. 225).[3]
Toxikologie
Bei oraler Einnahme oder Inhalation Lithiumselenid ist es giftig. Bei längerer oder wiederholter Exposition verursacht es Schäden an den Organen.[4]
Einzelnachweise
- Jacek Młochowski, Ludwik Syper: Lithium Selenide. John Wiley & Sons, Ltd, April 2001.
- Datenblatt Lithium selenide bei Sigma-Aldrich, abgerufen am 29. Juni 2019 (PDF).
- Li2Se. Materials Project, doi:10.17188/1199025.
- InfoCard zu Dilithium selenide der Europäischen Chemikalienagentur (ECHA), abgerufen am 29. Juni 2019.
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. The authors of the article are listed here. Additional terms may apply for the media files, click on images to show image meta data.



