Laropiprant
Laropiprant ist ein Arzneistoff aus der Gruppe der Prostaglandin-Antagonisten. In Kombination mit dem zur Behandlung von Fettstoffwechselstörungen verwendeten Lipidsenkers Nicotinsäure soll er nicotinsäurebedingte Nebenwirkungen des Flush-Syndroms (Erröten) reduzieren. Der Zulassungsinhaber stellte den Vertrieb der in ca. 70 Ländern (in Europa unter dem Markennamen Tredaptive) zugelassenen Nicotinsäure-Laropiprant-Kombination weltweit ein,[2] nachdem Ende 2012 Daten aus der kardiovaskulären Endpunktstudie HPS2-THRIVE mit Tredaptive bekannt wurden.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
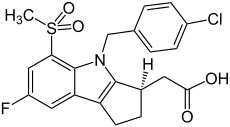 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Laropiprant | |||||||||||||||||||||
| Andere Namen |
[(3R)-4-(4-Chlor-benzyl)-7-fluor-5-methansulfonyl-1,2,3,4-tetrahydrocyclopenta[b]indol-3-yl]-essigsäure (IUPAC) | |||||||||||||||||||||
| Summenformel | C21H19ClFNO4S | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code |
C10AD52, Nicotinsäure-Kombinationsarzneimittel | |||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Wirkmechanismus | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 435,90 g·mol−1 | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Pharmakologie
Wirkmechanismus
Laropiprant ist ein selektiver Antagonist des Prostaglandin-D2-Rezeptor-Subtyps 1 (DP1). DP1 wird durch Prostaglandin D2 (PGD2) aktiviert; dies führt zu einer vermehrten cAMP-Ausschüttung, was eine Dilatation der Hautgefäße zur Folge hat. Der Patient leidet unter einem starken Wärmegefühl mit Hautrötung und Juckreiz, einem Flush-Syndrom. Durch Nicotinsäure (andere Namen: Niacin, Vitamin B3) wird die PGD2-Synthese stimuliert.
Pharmakokinetische Eigenschaften
Laropiprant hat eine Plasmaproteinbindung von mehr als 99 % und eine Plasmahalbwertszeit von 12 bis 17,7 Stunden.
Nutzen-Risiko-Verhältnis
Im Dezember 2012 wurde bekannt, dass in der kardiovaskulären Endpunktstudie HPS2-THRIVE (Heart Protection Study 2 – Treatment of HDL to Reduce the Incidence of Vascular Events) der primäre Endpunkt „Reduktion schwerwiegender vaskulärer Ereignisse“ nicht erreicht wurde. Auch in Kombination mit einem Statin reduzierte Tredaptive nicht das Risiko für schwerwiegende vaskuläre Ereignisse. Bei dieser Kombination war jedoch die Inzidenz einiger schwerwiegender nichttödlicher unerwünschter Nebenwirkungen im Vergleich zu einer Statin-Monotherapie statistisch signifikant erhöht,[3][4] weswegen Merck & Co., Inc. den Vertrieb von Tredaptive weltweit einstellte und einem erwarteten Verbot zuvorkam.
In einem Rote-Hand-Brief informierte Merck 2013, dass eine Behandlung mit Laropiprant beendet werden müsse.[5]
Literatur
- E. Lai, L. A. Wenning, T. M. Crumley, I. De Lepeleire, F. Liu, J. N. de Hoon, A. Van Hecken, M. Depré, D. Hilliard, H. Greenberg, G. O'Neill, K. Metters, K. G. Gottesdiener, J. A. Wagner: Pharmacokinetics, pharmacodynamics, and safety of a prostaglandin D2 receptor antagonist. In: Clinical pharmacology and therapeutics Band 83, Nummer 6, Juni 2008, S. 840–847, doi:10.1038/sj.clpt.6100345. PMID 17882161.
- J. F. Paolini, Y. B. Mitchel, R. Reyes, U. Kher, E. Lai, D. J. Watson, J. M. Norquist, A. G. Meehan, H. E. Bays, M. Davidson, C. M. Ballantyne: Effects of laropiprant on nicotinic acid-induced flushing in patients with dyslipidemia. In: The American journal of cardiology Band 101, Nummer 5, März 2008, S. 625–630, doi:10.1016/j.amjcard.2007.10.023. PMID 18308010.
Einzelnachweise
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- MSD stellt Vertrieb von Tredaptive® ein, DAZ-online 14. Januar 2013.
- European Medicines Agency: European Medicines Agency starts review of Tredaptive, Pelzont and Trevaclyn
- Rote-Hand-Brief von MSD vom 27. Dezember 2012. (PDF; 1,8 MB) Abgerufen am 3. Januar 2013.
- Rote-Hand-Brief von MSD vom 21. Januar 2013. (PDF; 1,6 MB) Abgerufen am 23. Januar 2013.