Leitfähigkeitsmessgerät
Ein Leitfähigkeitsmessgerät oder Leitfähigkeitssensor ist ein Gerät zur Messung der elektrischen Leitfähigkeit insbesondere von Flüssigkeiten und hier speziell von wässrigen Lösungen bzw. Elektrolyten oder Wasser verschiedener Reinheit.
Die elektrolytische Leitfähigkeit ist ein Summenparameter für gelöste, dissoziierte Stoffe. Die als Ionen dissoziierten Inhaltsstoffe verleihen dem Wasser eine elektrische Leitfähigkeit, die allerdings um eine oder mehrere Größenordnungen geringer ist als diejenige metallischer Leiter.
Leitfähigkeitssensoren werden unter anderem eingesetzt:
- in der Flüssigchromatographie zur Bestimmung von ionischen Verbindungen
- zur Kontrolle der Reinheit von Wasser, z. B. auch von deionisiertem Wasser, z. B. in Kühlkreisläufen
- in Verbindung mit Glukoseoxidase zur Blutzuckermessung
- als Indikator während einer Titration in der Konduktometrie

Grundlagen
Die Leitfähigkeit ist abhängig von:
- der Konzentration des gelösten Stoffes, der Art seiner Dissoziation und dem Dissoziationsgrad,
- der Wertigkeit und der Beweglichkeit der gebildeten Anionen bzw. Kationen,
- der Temperatur des Wassers (mit steigender Temperatur nimmt die Leitfähigkeit i. d. R. zu).
Ein Leitfähigkeitsdetektor besteht aus mindestens zwei Elektroden in zueinander paralleler oder in koaxialer Anordnung. Die Elektroden bestehen aus Edelstahl, Graphit oder, eher selten, aus Platin oder Titan. Die Elektroden besitzen eine definierte Fläche und stehen in einem definierten Abstand zueinander. Zusammen mit einem mechanischen Schutz und einem Elektroanschluss wird diese Anordnung als Messzelle bezeichnet.
Die Flüssigkeit zwischen den Elektroden verhält sich wie ein ohmscher Widerstand ; er ergibt sich zu
und wird für die Berechnung der elektrischen Leitfähigkeit herangezogen. Darin sind eine für die Flüssigkeit charakteristische Größe, deren spezifischer Widerstand, und eine vom geometrischen Aufbau der Messzelle abhängige Größe, bezeichnet als Zellkonstante. Ein in Längsrichtung von Ladungsträgern durchflossener gerader Leiter mit der Länge und konstanter Querschnittsfläche hat einen Widerstand . In diesem Idealfall eines gleichförmig stromdurchflossenen Leiters ist . Im allgemeinen Fall wird die Zelle auf einen Wert der Konstanten justiert, der im Datenblatt angegeben wird, oder die Zellkonstante wird durch die Widerstandsmessung an einer Kalibrierlösung mit bekanntem bestimmt. Gängige Werte liegen im Bereich = 0,01 … 1 cm−1.
Der Kehrwert des spezifischen elektrischen Widerstandes wird als elektrische Leitfähigkeit bezeichnet:
- .
Beim Einsatz eines Vier-Elektrodensensors ist der Messbereich deutlich höher mit 1 µS/cm bis 600 mS/cm. Ein weiterer Vorteil ist die höhere Unempfindlichkeit gegenüber störenden Widerständen, wie z. B. durch lange Anschlussleitungen, Verschmutzungen oder durch Polarisation. Diese Effekte führen zu Minderbefunden, da sie die von den Elektroden an die Messlösung angelegte Spannung reduzieren.
Neben dem hier beschriebenen konduktiven Messverfahren gibt es auch Leitfähigkeitssensoren nach dem induktiven Verfahren, die den Vorteil haben, dass die Messschaltung potentialfrei von der Flüssigkeit betrieben wird.
Die abgeleitete SI-Einheit der elektrischen Leitfähigkeit ist S/m (Siemens pro Meter). Verbreitet wird auch die Einheit S/cm verwendet. In der Praxis kommen außer bei extrem hohen Salzgehalten von Abwässern vorwiegend elektrische Leitfähigkeiten im Bereich von mS/cm bis S/cm vor.
Für die meisten Wässer lässt sich zwischen Leitfähigkeit und Ionengehalt die Faustregel anwenden:
- 2 µS/cm Leitfähigkeit entspricht ca. 1 mg/l Ionenkonzentration.[1]
Messschaltung
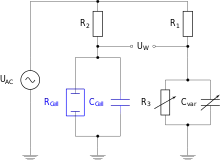
Zur Messung der Leitfähigkeit von Elektrolytlösungen bzw. des Widerstands der gefüllten Messzelle ist Gleichspannung häufig ungeeignet wegen elektrolytischer Polarisation an der Grenzfläche Elektrolyt/Elektrode, durch die eine Gegenspannung entsteht. Daher werden in diesem Falle Messzellen wie in einer Wien-Brücke betrieben.
Die Elektroden in der Elektrolytlösung bilden einen Kondensator. Dessen Kapazität ( in nebenstehender Abbildung) in dem einen Ast der Brückenschaltung muss durch eine einstellbare Kapazität im anderen Ast der Brückenschaltung kompensiert werden.
Der ohmsche Widerstand der Messzelle muss durch Einstellung von kompensiert werden. Bei abgeglichener Brücke ist
Bei kleinen Änderungen der Salzkonzentration wie zum Beispiel in der Blitzlichtphotolyse sind Messungen mit Brückenschaltungen von Vorteil, da Messbrücken auf Änderungen sehr empfindlich ausgelegt werden können und auch bei geringen Photonenflüssen ein gutes Signal-Rausch-Verhältnis (SRV) bieten.
Theoretischer Hintergrund
Die Zusammenhänge werden im Artikel Elektrolytische Leitfähigkeit beschrieben. Bei Rückschlüssen von der Ionenkonzentration auf die Gesamtkonzentration ist der Einfluss des Dissoziationsgleichgewichts zu beachten. Schließlich kommt mit steigender Konzentration noch ein Einfluss der interionischen Wechselwirkungskräfte auf die Leitfähigkeit in Betracht.
Hinweise:
- - und -Ionen weisen die mit Abstand größten Ionenbeweglichkeiten auf und haben damit wesentlichen Anteil an der Leitfähigkeit in wässrigen Lösungen. Ursache ist, dass der Ladungstransport über die durch Wasserstoffbrücken verbundenen Wassermoleküle erfolgt. Im Bereich von pH 6 bis pH 8, wie er in vielen natürlichen Wässern vorliegt, ist der Beitrag dieser Ionen zur Gesamtleitfähigkeit jedoch gering.
- Da in natürlichen Wässern, die stark verdünnte Elektrolytlösungen darstellen, die Wertigkeit der Ionen und ihre Beweglichkeit konstant sind, ist bei konstanter Temperatur die Leitfähigkeit eines Wassers lediglich eine Funktion seiner Ionenkonzentration bzw. seiner Ionenaktivität.
Einzelnachweise
- Leitfähigkeit (EC) und gelöste Feststoffe (TDS). (PDF; 99 kB) In: eurotronik.de. Abgerufen am 21. Juni 2018.