Kaliumheptafluorotantalat
Kaliumheptafluorotantalat, nach IUPAC genauer Kaliumheptafluoridotantalat(V), ist eine anorganische chemische Verbindung des Kaliums aus der Gruppe der Fluoridotantalate.
| Kristallstruktur | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
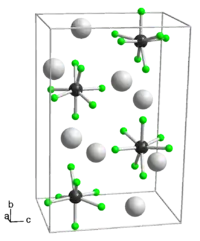 | ||||||||||||||||
| _ K+ _ Ta5+ _ F− | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Kaliumheptafluorotantalat | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Verhältnisformel | K2[TaF7] | |||||||||||||||
| Kurzbeschreibung |
weißer Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 392,13 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest[1] | |||||||||||||||
| Dichte |
4,11 g·cm−3[2] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit |
schwer löslich in Wasser (5 g·l−1 bei 15 °C)[3] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Gewinnung und Darstellung
Kaliumheptafluorotantalat kann durch Reaktion von Tantal(V)-oxid mit Flusssäure und Kaliumhydrogendifluorid gewonnen werden.[3]
Eigenschaften
Kaliumheptafluorotantalat ist ein weißer Feststoff, der in Form von glänzenden, dünnen, kurzen Nadeln vorliegt. Er ist bequem aus Flusssäure umkristallisierbar.[3] Die Verbindung besitzt über 200 °C eine orthorhombische Kristallstruktur mit der Raumgruppe Pmma (Raumgruppen-Nr. 51).[4] Ansonsten eine monokline Kristallstruktur mit der Raumgruppe P21/c (Nr. 14).[2][5]
Verwendung
Kaliumheptafluorotantalat wird zur elektrochemischen Synthese von Tantaldiborid TaB2 verwendet.[1] Es dient auch der Herstellung von Tantal durch Reduktion mit Natrium.[6] Auf ähnliche Weise wurde 1825 von Jöns Jakob Berzelius erstmals Tantal hergestellt, wobei dieser Kalium anstelle von Natrium verwendete.[2] K2[TaF7] dotiert mit Mn4+ wurde als Leuchtstoff für warmweiße LED vorgeschlagen, da es unter UV bzw. blauer Anregung intensive schmalbandige rote Lumineszenz aufweist.[7]
Einzelnachweise
- Datenblatt Potassium heptafluorotantalate(V), 99% bei Sigma-Aldrich, abgerufen am 15. Oktober 2013 (PDF).
- Anatoly Agulyansky: Chemistry of Tantalum and Niobium Fluoride Compounds. Elsevier, 2004, ISBN 0-08-052902-X, S. 7, 64 (eingeschränkte Vorschau in der Google-Buchsuche).
- Georg Brauer, unter Mitarbeit von Marianne Baudler u. a. (Hrsg.): Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band I. Ferdinand Enke, Stuttgart 1975, ISBN 3-432-02328-6, S. 263.
- Roger Blachnik (Hrsg.): Taschenbuch für Chemiker und Physiker. Band III: Elemente, anorganische Verbindungen und Materialien, Minerale. begründet von Jean d’Ans, Ellen Lax. 4., neubearbeitete und revidierte Auflage. Springer, Berlin 1998, ISBN 3-540-60035-3, S. 524 (eingeschränkte Vorschau in der Google-Buchsuche).
- C. C. Torardi, L. H. Brixner, G. Blasse: Structure and luminescence of K2TaF7 and K2NbF7. In: Journal of Solid State Chemistry. 67, 1987, S. 21–25, doi:10.1016/0022-4596(87)90333-1.
- Erwin Riedel, Christoph Janiak: Anorganische Chemie. Walter de Gruyter, 2011, ISBN 3-11-022567-0, S. 798 (eingeschränkte Vorschau in der Google-Buchsuche).
- Thomas Jansen, Florian Baur, Thomas Jüstel: Red emitting K2NbF7:Mn4+ and K2TaF7:Mn4+ for warm-white LED applications. In: Journal of Luminescence. Band 192, S. 644–652, doi:10.1016/j.jlumin.2017.07.061 (elsevier.com [abgerufen am 12. Oktober 2017]).
