Königsbussard
Der Königsbussard (Buteo regalis) ist ein mächtiger Greifvogel, der zur Gattung der Bussarde (Buteo) innerhalb der Familie der Habichtartigen (Accipitridae) zählt. Er ist weltweit der größte und schwerste Bussard.[1][2][3] Als Brutvogel ist die Art auf das südwestliche Kanada und die westlichen USA beschränkt. Die in Kanada und in den nördlichen USA brütenden Vögel sind Zugvögel mit Überwinterungsgebieten im Südteil des Brutgebietes, sowie südwärts bis Zentralmexiko, etwa bis zur Höhe des Río Lerma Santiago-Flusssystems. Der Königsbussard bevorzugt eher niedrig gelegene Gebiete, steigt aber in den Vorbergen der Rocky Mountains bis etwa 1500 Meter auf.[4] Er ist ein Greifvogel offener Landschaften wie Prärien, Wüsten-Beifuß-Steppen und Halbwüsten. In diesen oft baumlosen Habitaten baut er sein Nest auf höheren Exemplaren der Buschvegetation, auf von Menschenhand errichteten Strukturen, auf Felsklippen sowie gelegentlich auch am oder nahe dem Boden. Er wendet zwar einige Jagdtechniken an, ist aber hauptsächlich Ansitzjäger. Trotz einer Vielzahl von unterschiedlichen Beutetieren ist die Art in großem Maße von nur wenigen mittelgroßen Nagetieren wie Hasen, Erdhörnchen und Präriehunden abhängig, die einen Großteil der aufgenommenen Biomasse ausmachen. Ihr Vorhandensein bestimmt auch wesentlich Gelegegröße und Ausfliegerate.[5]
| Königsbussard | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
.jpg.webp)
Königsbussard (Helle Morphe) | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Buteo regalis | ||||||||||||
| (G. R. Gray, 1844) |
Der Königsbussard ist – wie viele Arten der Bussarde – sehr variabel gefärbt. Er erscheint in zwei Farbmorphen, einer hellen, die etwa 90 % des Bestandes umfasst und einer dunklen. Die Geschlechter weisen keinen Färbungsdimorphismus auf, Weibchen sind geringfügig größer, aber deutlich schwerer als die Männchen.[6]
Die Art ist monotypisch. Als Schwesterart wird der Raufußbussard (Buteo lagopus) angenommen, auch der Hochlandbussard gehört in die nächste Verwandtschaft.[7] Laut IUCN ist der Bestand der Art ungefährdet.[8] In den letzten 50 Jahren stieg der Brutbestand der Art signifikant an. Mit Stand Ende 2019 wird die Anzahl adulter Königsbussarde auf 110.000 Individuen geschätzt.[9]
Aussehen

Der Königsbussard ist ein wuchtiger, massiver Greifvogel, dessen helle Morphe auf der Unterseite weitgehend weiß erscheint, auf der Oberseite kastanienbraun. Insgesamt ist die helle Morphe auf der Unterseite jedoch sehr variabel gefärbt, sodass es neben fast weißen Individuen auch Vögel mit ausgedehnten und intensiven rostbraunen Zeichnungen gibt. Die dunkle Morphe ist auf der Oberseite, Unterseite und Kopf düster schwarzbraun, die Deckfedern der Flügel sind dunkelbraun, scharf kontrastierend zu den hellsilbergrauen Schwingen. Die Körperlänge liegt zwischen 56 und 69 Zentimetern, die Flügelspannweite liegt zwischen 122 und 152 cm, das Körpergewicht zwischen 977 und 2074 Gramm.[10] Die beiden Geschlechter unterscheiden sich in der Färbung nicht, Weibchen sind im Durchschnitt um 2–7 % größer und um bis zu 17 % schwerer.[6]
Der Königsbussard ist aufgrund seiner Größe, seiner sehr hellen (bzw. sehr dunkel-düsteren) Erscheinung und seines mächtigen, auffallend gelb markierten, tief gespaltenen Schnabels gut gekennzeichnet. Auffallend ist zudem ein rostbraunes V vor dem Schwanzansatz, das durch die rostrote Befiederung der Läufe gebildet wird.
Helle Morphe


Die Mehrzahl der Königsbussarde gehört der hellen Morphe an. In manchen Populationen fehlen dunkel gefärbte Individuen völlig, in anderen können bis zu 10 % der Individuen dunkelmorphig sein.[10]
Rücken, Schultern und Flanken sind meist dumpf kastanienbraun. Die meisten Federn sind cremebräunlich gerandet, wodurch insgesamt ein gesprenkelter Eindruck entsteht. Der große Kopf ist auf hell graubräunlichem Grund dunkel gestrichelt; diese graubräunliche Färbung geht im Bereich des Mantels in die Braunfärbung des Rückengefieders über. Der mächtige blaugraue Hakenschnabel ist tief gespalten und deutlich dottergelb markiert. Im basalen Drittel ist er von einer gelben Wachshaut umgeben. Der Schnabelspalt reicht bis Mitte Augenhöhe. Die Iris ist meist dunkelgelb oder kastanienbraun. Die Unterseite ist sehr hell. Kehle, Brust und Bauch sind auf reinweißem, gelegentlich auch gelblich oder bräunlich behauchtem Grund in unterschiedlicher Intensität rostbraun gestrichelt oder gefleckt. Vor allem die untere Bauchseite und die hinteren Flanken weisen oft eine intensivere Fleckung auf. Die weißen Schwingen sind oft undeutlich gebändert und auf der Unterseite subterminal undeutlich dunkel gerandet; die tief gefingerten Handschwingen sind in der terminalen Hälfte dunkel-bräunlich. Die unteren Flügeldecken sind unterschiedlich stark intensiv rostrot gesprenkelt, ein Färbungsdetail, das für die englische Bezeichnung der Art Ferruginous Hawk ausschlaggebend war. Oft sind diese Farbelemente linienförmig angeordnet. Auf der Oberseite sind die Flügel bräunlich. Wenn die Handschwingen gespreizt sind, zeigt sich in ihrem basalen Bereich ein deutliches, helles Fenster. Die meisten Innenfahnen der Armschwingen sind hellgrau bis weißlich, wodurch auf der Oberseite die inneren Handschwingen sowie die Armschwingen eine leichte hell-dunkel Schattierung aufweisen. Der Bürzel ist rostbraun, der Schwanz ist auf der Oberseite weiß mit einer oft leicht bräunlichen Randung der Steuerfedern, auf der Unterseite weiß mit nur angedeuteten Subterminal- und Terminalbinden. Die dicht befiederten Läufe sind bis zu den massiv bekrallten, orangegelben Zehen (bei adulten Individuen im Nahrungsstress gelbgrünlich) auf hellem Grund dicht rostrot, längslinear gesperbert. Diese Zeichnung bildet beim fliegenden Vogel mit angezogenen Läufen ein auffälliges V.[10][6]
Dunkle Morphe
Individuen der dunklen Morphe wirken aus der Entfernung einheitlich dunkel-düster schwarzbraun. Genauere Farbabstufungen sind nur aus der Nähe festzustellen.
Das Gefieder der gesamten Oberseite ist matt dunkelbraun, manchmal auch etwas heller rötlichbraun. Die meisten Federn sind etwas heller gerandet, sodass eine undeutliche Sprenkelung entsteht. Im Nackengefieder sind oft einige weiße oder silberfarbene strichförmige Farbelemente erkennbar. Oberkopf und Stirn sind ebenfalls meist ungezeichnet schwarzbraun. Nur der Bereich zwischen Schnabelansatz und Auge ist etwas heller, oft ist ein heller Überaugenstreif erkennbar. Der dunkel hornfarbene Schnabel ist im basalen Drittel von einer gelben Wachshaut überzogen. Die Oberseite der Flügel ist dunkelbraun, wobei die Oberflügeldecken etwas heller sind als die eher schwarzbraunen Schwingen. In ihrem basalen Abschnitt zeigen die gespreizten Handschwingen ein deutlich silberfarbenes Fenster. Die gesamte Unterseite und die Unterflügeldecken sind fast ungezeichnet schwarzbraun. Nur im Brustbereich lockern einige helle, weißliche Striemen diese düstere Farbgebung auf. Die befiederten Läufe sind undeutlich dunkel rötlichbraun gesperbert. Die äußeren, tief gefingerten Handschwingen sind dunkel silbergrau und deutlich grauschwarz begrenzt, die übrigen Schwingen sind weißlich mit leicht bräunlichen Rändern und einem eher undeutlichen graubraunen Subterminalband. Der Schwanz ist auf der Oberseite hell silberfarben, auf der Unterseite weitgehend weiß. Die Iris ist gelborange, die Zehen sind gelblich.[10][6]
Jugendgefieder

Zwischen August des Geburtsjahres und Mai des Folgejahres zeigen Jungvögel das Jugendgefieder. Auf der Oberseite ist es dunkler als das Erwachsenengefieder, meist ohne rostbraune oder hell kastanienbraune Anteile. Häufiger und auffälliger als im Erwachsenengefieder sind weiße Federbasen, vor allem im Mantel- und Nackenbereich sowie am Oberkopf. Der helle Überaugenstreif, der im Erwachsenengefieder der hellen Morphe fast verschwindet, ist deutlich. Die Brust weist eine markante braunorange Tönung in Form eines Brustlatzes auf. Die untere Brust und die Bauchseite sowie die Unterflügeldecken sind eher spärlich matt dunkelbraun gefleckt; die typischen leuchtend rostbraunen Farbelemente des Adultgefieders fehlen. Die Färbung der Schwingen und der Steuerfedern entspricht weitgehend der von erwachsenen Bussarden, während die Gelbfärbung von Wachshaut und Zehen deutlich blasser ist. Die Befiederung der Läufe ist fast reinweiß, sodass auch das V-Zeichen fliegender ausgefärbter Königsbussarde fehlt.
Flug
Die Spannweite der Art beträgt etwa das Zweieinhalbfache der Körperlänge, also mehr als 1,5 Meter. Königsbussarde fliegen mit langsamen, tief ausholenden, kräftigen Flügelschlägen und segeln mit leichter V-Stellung mit tief gefingerten äußeren Handschwingen. Für kurze Zeit vermag die Art auch zu rütteln. In der Vorbrutzeit kreisen sie in Thermikschläuchen und steigen hoch auf. Beutetiere werden meist in einem Fang zum Nest getragen.[11]
Mauser
Nestlinge beginnen mit etwa zwei Wochen das Dunengefieder zu wechseln. Sie vermausern zuerst das Kleingefieder und Körpergefieder, danach die Flügeldecken, die Schwingen und die Steuerfedern, zuletzt das Kopfgefieder. Diese Mauser dauert zwischen 25 und 40 Tagen und ist mit dem Ausfliegen weitgehend abgeschlossen.[12] Bevor im Mai des nächsten Jahres die Mauser in das definitive Erwachsenengefieder beginnt, können einige Teilmauserungen des Körpergefieders, manchmal auch einzelner Schwingen und Steuerfedern vorangegangen sein. Diese Mauser, bei der in mehreren Einzeletappen das gesamte Gefieder vermausert wird, dauert bis zu 100 Tage. Brutvögel beginnen mit dem Federwechsel bereits während der Brutzeit (Weibchen schon in der Legeperiode). In der Nestlingszeit wird diese Mauser unterbrochen und nach der Brutzeit fortgesetzt. Meist wird sie erst im Winterquartier abgeschlossen.[12]
Lautäußerungen
Königsbussarde sind akustisch eher unauffällig. Nestlinge geben leise Bettellaute von sich. Altvögel sind nur in der Paarbildungsperiode und Vorbrutzeit häufiger zu hören, außerhalb dieser Zeit hört man die Art fast nicht, auch dann nicht, wenn sich mehrere Individuen zusammenfinden.[13] Häufigster Laut ist ein bussardtypisches langgezogenes, oft leicht tremolierendes Wiiiiiiiiääh, das in relativ großen Abständen meist von fliegenden, gelegentlich auch von sitzenden Individuen geäußert wird. In der Paarbildungszeit dient er als Kontaktruf und wird zur Revierabgrenzung eingesetzt; ein kurzes, scharfes, deutlich auf der ersten Silbe betontes und meist gereihtes Wiääh ist ein universeller Alarmruf. Dieser Ruf hat eine große Ähnlichkeit mit den Rufen der Silbermöwe.[14][15]
Verbreitung
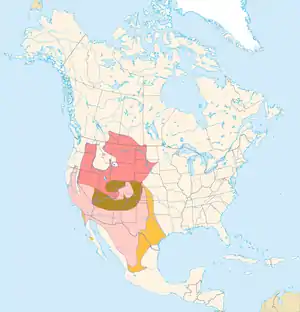
pink: Brutgebiet (Sommer), grün gestreift: Brutgebiet (ganzjährig), hellrosa: Überwinterungsgebiet, gelb gestreift: seltene Wintervorkommen
Das Brutgebiet des Königsbussards liegt zur Gänze im südwestlichsten Teil Kanadas (ausgenommen British Columbia) und den westlichen und südwestlichen Teilen der USA. Es wird durch die Rocky Mountains in zwei verschiedene Ökoregionen getrennt: Die Graslandschaften der Prärien östlich der Rockies und die Buschsteppen und Halbwüsten westlich des Gebirges.
Im Detail ist die Art Brutvogel im südöstlichen Alberta im südlichen Saskatchewan und im äußersten Südwesten Manitobas. Nach Süden verläuft die Ostgrenze des Brutgebietes im zentralen Norddakota, reicht im östlichen Süddakota am weitesten nach Osten und wendet sich in Nebraska wieder nach Westen. Kansas und Oklahoma werden nur im äußersten Westen berührt, Texas in der nordwestlichen Ecke des Texas Panhandle. Nach Westen hin verläuft die Südgrenze des Brutgebietes im zentralen New Mexico und im zentralen Arizona. Die Westgrenze verläuft im westlichen Nevada und erreicht Kalifornien im nordöstlichen Grenzgebiet des Staates. Im ostzentralen Washington liegen die nördlichsten Brutplätze des Königsbussards in den USA. Innerhalb dieses Gebietes fehlt die Art in weiten Teilen des nordöstlichen Idaho, im westlichen Montana und im nordwestlichen Wyoming sowie den zentralen und südwestlichen Gebieten Colorados. Auch die Black Hills in Süddakota sind nicht besiedelt. Aus British Columbia liegt nur ein Brutnachweis von 1968 vor; die ersten Bruten in Kalifornien wurden im Jahr 1988 festgestellt[16]
Winterverbreitung
Die Winterquartiere der Art liegen in den südlichen Bereichen des ganzjährigen Brutgebietes, in Kalifornien und den südlichen Bundesstaaten der USA. Sie erreichen in Kalifornien den Pazifischen Ozean und in Texas den Golf von Mexiko. Es wird vermutet, dass etwa 20 % der ziehenden Königsbussarde in Mexiko überwintern, die meisten in den nördlichen Bereichen. Einzelne Nachweise stammen aber auch aus Gebieten in Zentralmexiko, südwärts bis in die Umgebung von Mexiko-Stadt.[17] Seit etwa 2000 wird eine steigende Anzahl von Überwinterern in nördlichen Regionen wie Montana und Idaho festgestellt.[1]
Zugverhalten
Die Populationen Kanadas und jene der nördlichen USA sind obligatorische Zugvögel. Ihre Überwinterungsgebiete liegen in den südlichen Bereichen des ganzjährigen Brutgebietes, an der Pazifikküste bis zur Baja California und zum Teil, wenn auch in geringer Zahl, am Golf von Mexiko. Aus Mexiko liegen wenige Ringfunde vor; die Rückmeldungen lassen darauf schließen, dass die Mehrzahl der Überwinterer in den nordöstlichen Bundesstaaten bleibt, dort, wo die letzten Kolonien des Mexikanischen Präriehundes liegen. Eine geringe Anzahl zieht aber weiter bis Zentralmexiko; diese Vögel legen Zugdistanzen von über 5000 Kilometer zurück; die meisten der ziehenden Königsbussarde sind jedoch Kurzstreckenzieher.[17] Jungvögel verlassen zuerst den Ort ihrer Geburt. Meist ziehen sie bald nach dem Ausfliegen im Juli oder August ab und streifen anfangs ungerichtet umher, um erst nach und nach südliche Richtungen einzuschlagen. Sobald nach der Mauser wieder ein flugtaugliches Gefieder zur Verfügung steht, folgen die Weibchen. Zuletzt ziehen die Männchen ab, deren Wegzug bis Anfang Oktober andauern kann[18]
Die Nordamerikanische kontinentale Wasserscheide bestimmt auch weitgehend das Zugverhalten. Nur 4,7 % der östlich dieser Wasserscheide beringten Vögel wurden im Winter westlich von ihr festgestellt; häufiger dagegen überwintern Westvögel in der Osthälfte.[18]
Der Heimzug erfolgt im Spätwinter und zeitigen Frühjahr. Ende März/Anfang April sind die meisten Brutplätze wieder besetzt.[1]
Lebensraum
Brutgebiet

Das Brutgebiet des Königsbussards wird durch den Hauptkamm der Rocky Mountains in einen östlichen und westlichen Teil getrennt, in denen jeweils verschiedene Ökoregionen vorherrschen: dominieren im Osten die flachen oder rollenden Grasgebiete der Prärien, herrschen im westlichen Teil Buschsteppen, Halbwüsten und Wüsten vor. Ein ausreichendes Angebot an Beutetieren, vornehmlich mittelgroßer Nager, ist die wesentlichste Voraussetzung für einen geeigneten Brutplatz. Kurzrasige Abschnitte und Gebiete mit wenig Bodenbewuchs werden wegen der leichteren Erreichbarkeit der Beutetiere bevorzugt. Ebenso sind geeignete Ansitze – seien sie anthropogener Natur (Telegrafenmasten, Bewässerungsanlagen, Scheunen und ähnliches) oder von natürlichem Ursprung (Steinklippen, Höhere Büsche, Bäume) – und entsprechende Nistmöglichkeiten unabdingbare Requisiten eines Bruthabitats. Generell meidet die Art in beiden Ökoregionen tiefe Canyons, Gebiete in über 1500 Metern Höhe und ausgedehnte Wälder.[1][19]

Im östlichen Teil des Verbreitungsgebietes bevorzugt die Art offenes – im Idealfall mit Bäumen oder Felsen durchsetztes – Grasland; auch Gehölze entlang von kleinen Wasserläufen sind für eine Brutansiedlung positiv. Landwirtschaftlich genutzte Abschnitte und Siedlungen werden bis zu einem bestimmten Ausmaß toleriert. Im westlichen Teil dominieren Steppen und Halbwüsten den Lebensraum der Art. Sie brütet in Steppen mit stark aufgelockerter Buschvegetation (Wüsten-Beifuß und Bestände von Atriplex canescens (Saltbush)), meidet aber Gebiete, in denen die Bestände dieser Arten zu dicht stehen. In etwas höheren Lagen kommt die Art bis an die Ränder der Kiefer-Wacholder-Zone vor. In diesen Halbwüstengebieten ist der leichte Zugang zu Wasser eine wesentliche Voraussetzung für eine Brutansiedlung.[19][4]
Überwinterungsgebiet
Brutvögel aus den Präriegebieten bevorzugen auch im Winter ausgedehnte Graslandschaften, vor allem solche, in denen Präriehunde häufig sind. Königsbussarde der westlichen Buschsteppen und Halbwüsten suchen auch im Winter meist ähnliche Habitate auf, obwohl die Häufigkeit wichtiger Beutetiere wie Antilopenziesel, Taschenratten und Hasenartigen ausschlaggebender für die Wahl des Winterquartiers ist als dessen Vegetation.[19]
Raumbedarf und Territorialität
Der Raumbedarf der Art hängt sehr stark mit Nahrungsangebot und Landschaftstyp zusammen. Entsprechend breit streuen die diesbezüglichen Angaben. Während Christie noch eine Mindestgröße eines Brutgebietes von 430 km² angibt,[20] zeigen neue Untersuchungen ganz andere Ergebnisse. Zwar liegt die Reviergröße eines Paares, das in einem Graslandhabitat mittlerer Güte brütet, bei etwa 100 km², doch wurden in Utah Brutreviere mit einer Größe von nur 5,9 km² festgestellt und die Größe einiger stadtrandnaher Reviere lag unter 3 km².[21] Als Mindestabstand beflogener Nester wurden bislang 3,4 km erhoben. Wenn die Art Winterreviere etabliert, sind sie kleiner als die Brutreviere und werden nicht energisch verteidigt. In Colorado wurde eine Durchschnittsgröße von 3,53 km² festgestellt.[21]
Königsbussarde sind während der Brutzeit streng territorial. Sie verteidigen zumindest die Kernzonen ihres Reviers gegenüber Artgenossen energisch, intensive Berührungskämpfe sind jedoch selten. Die Randzonen benachbarter Reviere können überlappen. Häufig brüten andere Greifvögel wie der Präriebussard und der Rotschwanzbussard oder Eulen wie der Virginia-Uhu innerhalb von Revieren des Königsbussards. Sie werden zwar aus unmittelbarer Nestnähe vertrieben, innerhalb des Reviers jedoch geduldet. Die Winterterritorialität ist nur schwach ausgeprägt. Häufig jagen Königsbussarde gemeinschaftlich und schlafen in einem Schlafbaum, nur wenige Meter voneinander entfernt.[22]
Nahrung und Nahrungserwerb

Das Beutespektrum des Königsbussards ist sehr groß. Es umfasst eine Vielzahl an Nagetieren, viele Vögel, einige Reptilien sowie große Insekten. Trotz dieser Vielfalt, lassen sich einige wenige Beutetiere nennen, deren Vorhandensein für diesen Greifvogel essenziell ist, und die einen hohen Prozentsatz der aufgenommenen Biomasse ausmachen. Für die Populationen westlich der Rocky Mountains sind das verschiedene Hasenarten (Lepus ssp.) und Baumwollschwanzkaninchen (Sylvilagus ssp.), für die östlich des Gebirges beheimateten Individuen Präriehunde und Erdhörnchen.[23] Daneben können noch Taschenratten vor allem im Winter zur Hauptbeute werden.

Diese Säugetiere machen im Durchschnitt etwa 80 % der Biomasse aus und viele Bussarde brüten gezielt in der Nähe ihrer Kolonien. Gelegegröße, Bruterfolg und Ausfliegerate hängen ganz wesentlich von Vorhandensein und Anzahl dieser Beutetiere ab.[1] Regelmäßig werden Vögel verzehrt. Das Artspektrum reicht von kleinen Singvögeln bis zu Möwen und Hühnervögeln, wie dem Beifußhuhn oder dem in die USA zu Jagdzwecken eingebürgerten Fasan. Quantitativ stehen nach einer Untersuchung aus Nebraska Vögel mit 12 % der Biomasse an zweiter Stelle der Energielieferanten.[23] Bei Gelegenheit erbeuten Königsbussarde auch Reptilien, wobei sie große Arten wie Schwarznatter oder Bullennatter bevorzugen. Immerhin 4 % der zugeführten Biomasse gehen auf ihr Konto. Für den Energiehaushalt nicht wesentlich, aber doch regelmäßig konsumiert, sind schwärmende, große Insekten, vornehmlich Heuschrecken und Grillen sowie verschiedene Amphibienarten.[20]
Der Königsbussard beherrscht einige Jagdtechniken, vor allem aber ist er ein Ansitzjäger. Von einem geeigneten erhöhten Ansitz, etwa einem Leitungsmasten, einem höheren Busch oder Baum oder einer Felsformation beobachtet er die Gegend. Erblickt er geeignete Beute, gleitet er vom Ansitz und schwebt meist ohne Flügelschlag im niedrigen Gleitflug über das Beutetier, das er am Boden mit einem kräftigen Nackenbiss tötet. Die Jagddistanzen überschreiten selten 100 Meter, die Ansitze werden regelmäßig gewechselt.[23] Häufig jagt die Art auch auf dem Boden, indem sie in der Nähe von frisch ausgeworfenen Nagetierbauen wartet und unvorsichtige Tiere mit einem Flugsprung erbeutet. Fliehende Tiere verfolgt er über kurze Strecken hüpfend oder flügelspringend. Vor allem Taschenratten und Erdhörnchen fallen dem Bussard auf diese Art häufig zum Opfer. Im Winter sind häufig gemeinschaftliche Bodenjagden mehrerer Bussarde zu beobachten. Gelegentlich, vornehmlich entlang von Abhängen, jagen Königsbussarde auch mittels eines langsamen, niedrigen Gleitfluges, der bei günstigem Wind auch durch Rüttelphasen unterbrochen werden kann. Gelegentlich jagen Königsbussarde anderen, kleineren Greifvögeln Beutetiere ab, werden aber auch selbst vor allem von Steinadlern und Weißkopfseeadlern parasitiert.[23]
Brutbiologie
Paarbildung, Neststandort und Nest
Wann die Geschlechtsreife dieser Art eintritt, ist nicht bekannt, doch die Mehrzahl der Individuen brütet im Frühjahr des zweiten Lebensjahres zum ersten Mal. Bruten einjähriger Vögel wurden bislang nicht festgestellt. Auch Dauer und Art der Paarbindung sind noch nicht ausreichend erforscht. Die Paarbindung scheint sich bei residenten Paaren nach der Brutzeit nicht zu lösen; dagegen fehlen Hinweise auf eine aufrechtbleibende Verpaarung bei ziehenden Königsbussarden. Die hohe Nestortstreue macht jedoch Wiederverpaarungen letztjähriger Partner wahrscheinlich. Königsbussarde brüten einmal im Jahr; Ersatzbruten scheinen auch bei frühem Gelegeverlust nicht stattzufinden.[24]

Die Paarbildung beginnt bei residenten Paaren bereits Ende Februar, bei ziehenden sofort nach Ankunft im Brutrevier, meist in der zweiten Märzhälfte. Das Balzritual beschränkt sich weitgehend auf Schauflüge über dem Revier. Vor allem das Männchen fliegt dabei mit besonders akzentuierten Flügelschlägen, gaukelt zuweilen, oder stürzt plötzlich trudelnd ab. Zuweilen umfassen einander die Partner auch mit den Krallen und kreisen spiralig zu Boden, bevor sie sich wieder lösen. Während dieser Schauflüge rufen beide Partner häufig. Den häufigen Kopulationen – meist in Nestnähe oder auf dem fertigen oder halb fertigen Nest – gehen oft solche Schauflüge voraus, oder aber Futterübergaben des Männchens können eine Kopulation einleiten. Auch der Nestbau selbst, der unmittelbar nach Eintreffen im Brutrevier beginnt, ist ein wesentlicher Teil der Paarbildung. In dieser Zeit rasten oder ruhen die Partner oft nahe beieinander, ohne jedoch Körperkontakt zu haben.[24]
In den meisten Bruthabitaten der Art sind Nistmöglichkeiten über Bodenniveau rar. Dennoch bauen Königsbussarde nur dann ihr Nest direkt auf dem Erdboden, wenn keine erhöhten Plätze zur Verfügung stehen. Deutlich bevorzugt werden höhere Büsche oder Bäume, Felsklippen, Strukturen anthropogener Natur, wie Masten von Stromleitungen, Bewässerungsanlagen, Bohrtürme und anderes, sowie Nisthilfen auf Plattformen.[25] Großangelegte Untersuchungen sowohl der West- als auch der Ostpopulationen ergaben, dass Königsbussarde ihre Nester zu 49 % in hohen Büschen oder Bäumen, zu 21 % in Felsformationen oder auf Findlingen, zu 12 % auf Strukturen anthropogener Genese und zu 10 % auf leichten Bodenerhebungen errichten. Die Nesthöhe ist entsprechend variabel und reicht vom Bodenniveau bis etwa 20 Meter über dem Erdboden. In letzter Zeit werden immer mehr künstliche Nistplattformen errichtet, die auch häufig angenommen werden.[25]
Das Paar baut innerhalb einer Woche ein neues Nest oder repariert ein altes. Meist werden mehrere Nester wieder hergestellt, bevor die Eiablage beginnt. Das Männchen schafft das meiste Material herbei, während das Weibchen sich stärker um die Konstruktion kümmert. Der Innenaufbau besteht aus eher dünnen, biegsamen Zweigen, oft von Beifuß und anderen Sträuchern, die mit Grashalmen miteinander verwoben werden. Innen wird der etwa 30 Zentimeter tiefe Napf mit weichen Materialien, wie Tier- und Pflanzenwolle, Federn, aber auch Papierresten und anderen Abfällen ausgekleidet. Die Außenkonstruktion besteht aus stärkeren Ästen, die sehr stabil miteinander verflochten und verkeilt werden. Früher verwendeten Königsbussarde für die Außenkonstruktion häufig Bisonknochen. Außen wird es oft mit Rindenstücken aber auch mit grünen Zweigen verkleidet. Das Nest ist schon als Neubau für einen Vogel dieser Größe sehr groß, durch oft vieljährige Benutzung wächst es jedoch zu einer gewaltigen Konstruktion von mehr als 1,5 Metern Außendurchmesser und einer ebensolchen Höhe heran.[25]
Gelege und Jungenaufzucht
Die Legezeit liegt im Bereich zwischen dem 38. und 49. Breitengrad zwischen dem 20. März und Anfang Mai, in nördlicheren Regionen etwa zwei bis drei Wochen später.[26] Das Gelege besteht aus 2 – 4 (1 – 8) cremeweißen Eiern mit den durchschnittlichen Maßen von 60,92 mm × 47,75 mm. Meist sind sie bräunlich gefleckt oder getupft, nicht selten aber auch rein weiß. Der Legeabstand beträgt zwei Tage; Brutbeginn ist nach Ablage des ersten Eis, sodass die Nestlinge zu Beginn der Fütterungszeit beträchtliche Entwicklungsunterschiede aufweisen. Die meiste Zeit brütet das Weibchen; für kurze Intervalle wird es zu Beginn der Brutzeit vom Männchen abgelöst, später wird die Beteiligung des Männchens geringer. Die Brutzeit dauert 32 – 33 Tage. Bei einem Vierer-Gelege schlüpfen die Jungen innerhalb von vier Tagen. Während der Brutzeit und in den ersten 10 Tagen der Nestlingszeit versorgt das Männchen fast ausschließlich das Weibchen und später die Jungen mit Nahrung, die es am Nestrand ablegt. Das Weibchen beginnt erst wieder zu jagen, wenn die Nestlinge ins erste Jugendgefieder mausern und imstande sind, Beutetiere selbstständig zu zerlegen.[26] Ob Bruthilfe vorkommt ist nicht klar; jedenfalls wurden gelegentlich drei adulte Individuen an einem Nest mit Küken beobachtet.[26]
Nestlingszeit

Nach dem Schlupf sind die Küken unfähig den Kopf zu heben; die ersten Lebenstage verbringen sie meist liegend, später sitzend. Mit etwa 7 Tagen können sie ihren Standort im Nest wechseln, mit 20 stehen sie im Nest; in diesem Alter beginnen sie auch selbstständig Beutetiere zu zerlegen, nachdem sie zuvor vom Weibchen mit mundgerechten Happen gefüttert wurden. Dies ist auch die Zeit, in der das Weibchen wieder zu jagen beginnt und die Jungen über längere Zeiträume allein bleiben. Aggressionsverhalten älterer Küken gegenüber jüngern findet statt, doch ist es nicht sehr ausgeprägt; Fratrizid kommt selten vor. Das Training der Flugmuskulatur beginnt etwa mit 30 Tagen; nach frühestens 38 Tagen verlassen sie das Nest. Die Jungenentwicklung kann sich bei ungünstiger Witterung sehr stark verlangsamen, sodass die Nestlingszeit insgesamt bis zu 50 Tage dauern kann. Zwar sind die Jungvögel kurz nach dem Ausfliegen imstande, selbstständig Beute zu schlagen, doch werden sie noch mindestens zwei Wochen von den Altvögeln betreut.[26][20]
Dismigration, Bruterfolg und Lebenserwartung
Jungvögel schließen sich nach der Führungszeit häufig zu Jugendgruppen zusammen, die meist ungerichtet umherstreifen, sich jedoch nicht allzu weit vom Neststandort entfernen. Erst nach einigen Wochen des Vagabundierens schwenken sie auf einen Südkurs ein und beginnen mit der Migration. Jungvögel aus residenten Populationen behalten während der Wintermonate ihr nomadisches Leben bei. Die Brutortstreue der Art ist sehr groß: Altvögel kehren viele Jahre hindurch in die Nestumgebung zurück, die meisten Jungvögel versuchen in der Nestumgebung ein eigenes Revier zu etablieren.[27]
Bruterfolg und Ausfliegerate schwanken von Jahr zu Jahr beträchtlich. Wenn die Hauptbeutetiere knapp sind, brüten Königsbussarde überhaupt nicht oder reduzieren die Gelegegröße. In guten Nahrungsjahren sind dagegen Vierer- und Fünfergelege nicht selten und bei entsprechender Witterung gelingt es den Eltern auch oft, alle Jungvögel zum Ausfliegen zu bringen. Insgesamt ist der Bruterfolg, bedingt durch Witterungseinflüsse, Nahrungsmangel und Prädation nicht sehr groß. Eine Untersuchung im südlichen Idaho, die sich über die Jahre 1977 – 1994 erstreckte, erbrachte einen Bruterfolg von nur 45,6 %, das heißt, von allen begonnenen Bruten brachten nur knapp die Hälfte zumindest ein Junges zum Ausfliegen.[28] Werden jedoch nur die erfolgreichen Bruten herangezogen, so ist die Ausfliegerate mit durchschnittlich etwa 2,5 Jungvögeln pro begonnener Brut recht hoch.[28]
Etwa 45 % der Jungvögel überleben ihr erstes Lebensjahr nicht. Danach flacht die Sterbekurve sehr stark ab. Das Durchschnittsalter wiedergefundener nestjung beringter Vögel lag bei etwas mehr als 2 Jahren. Das Höchstalter in freier Wildbahn wird mit 20 Jahren angegeben; Vögel in Gefangenschaft werden manchmal älter.[28]
Systematik
Seit der erstmaligen Bestimmung der Art 1838 wurde sie vielfach taxonomisch umbewertet und erhielt die Namen Archibuteo regalis, Buteo californicus, Lagopus ferrugineus, Buteo ferrugineus, Archibuteo ferrugineus und Triorchis ferrugineus. Archibuteo und Triorchis sind heute obsolet, und die Zuordnung zu Buteo steht außer Zweifel.[29][1] Das erstvergebene Artepitheton ferrugineus blieb im amerikanischen Trivialnamen Ferruginous Hawk erhalten.
1838 benannte Martin Hinrich Lichtenstein ein überwinterndes Exemplar dieser Art aus Monterey Falco ferrugineus. 1922 erkannte Erwin Stresemann, dass Falco ferrugineus schon belegt war, weil bereits 1835 Alexander von Nordman Falco ferrugineus als Bezeichnung für den Däumlingssperber (Accipiter superciliosus) gewählt hatte. Damit wurde Lichtensteins Taxierung ungültig. Die nächste freie, gültige Bezeichnung war Archibuteo regalis, ein Binomen, das George Robert Gray 1844 für den Balg – ebenfalls eines Überwinterers – gewählt hatte, der aus Real del Monte stammte und sich im British Museum befand. Unklar ist, von wem dieser Balg gesammelt wurde, vermutet werden Ferdinand Deppe oder William Bullock.[29] Gray wurde damit Erstbeschreiber. Obwohl Buteo ferrugineus kein gültiger Name war, scheint er in der Literatur des späten 19. Jh. und frühen 20. Jh. immer wieder auf, bis er in der 4. Edition der Birdlist der American Ornithologists' Union (1931) offiziell eingeführt wurde.[30][31][29]
Die verwandtschaftlichen Beziehungen der Art sind nicht völlig geklärt. Eine molekulargenetische Untersuchung aus dem Jahre 2003 stellt Buteo lagopus als Schwesterart dar, ein Verwandtschaftsverhältnis, das aufgrund morphologischer- und verhaltensbiologischer Ähnlichkeiten schon zuvor vermutet wurde und zur Etablierung der Gattung Triorchis geführt hatte.[7] Insbesondere fehlen neue Arbeiten, die die verwandtschaftliche Beziehung zwischen B. regalis und B. hemilasius zum Gegenstand haben.[32]
Trotz des großen, und durch die kontinentale Wasserscheide in zwei Hälften geteilten Verbreitungsgebietes, werden keine Unterarten beschrieben.
Bestand und Bedrohung
Mit Stand Ende 2019 gilt der Bestand des Königsbussards als ungefährdet. (IUCN=LC)[8]. Der Gesamtbestand in Nordamerika wird auf 110.000 Individuen geschätzt. Die Populationsentwicklung ist im Gesamten mit einem jährlichen Zuwachs von 0,61 % (1966 – 2015) positiv, regional sind jedoch auch Bestandsrückgänge zu verzeichnen. Vor allem in den Mischgrasprärien des Mittleren Westens wurden Bestandseinbußen von bis zu 1,6 % jährlich verzeichnet.[28] Neben den zur Brutzeit jährlich unterschiedlichen Wetter- und Nahrungsbedingungen, ist das Vorhandensein geeigneter Nistmöglichkeiten für die Bestandsentwicklung eine bestimmende Variable. Bruten auf stark erhöhten Strukturen zeitigen signifikant bessere Ausfliegeraten als Bruten in Bodennähe. Der Errichtung von Nistplattformen kommt also eine besondere Bedeutung für die Bestandsentwicklung der Art zu.[28]
Vor allem Nestlinge und Jungvögel werden häufig Opfer von Schlechtwetterperioden, Nahrungsmangel und Prädation. Rotluchse, Kojoten, Silberdachse und Füchse, sowie eine Reihe von Greifvögeln und der Virgina-Uhu stellen Nestlingen nach, Krähen können unbewachte Gelege zerstören. Erwachsene Individuen sind durch Parasiten und Krankheiten gefährdet, in zunehmendem Maße aber durch Zerstörung ihres Lebensraums, sowie durch Kollisionen im Straßenverkehr und mit Windturbinen. Regional wird versucht, die Bestände von Päriehunden durch Abschuss und Vergiftung zu kontrollieren; diese Kampagnen wirken sich negativ auf Beutegreiferpopulationen aus, sowohl durch daraus resultierenden Nahrungsmangel als auch durch sekundäre Vergiftung aufgrund landwirtschaftlicher Schädlingsbekämpfungsprogramme. Die Art ist sehr empfindlich gegenüber Störungen. Zunehmender Freizeittourismus auch in entlegenen Gebieten kann zum Verlassen von Brutterritorien und zur Aufgabe von Gelegen führen. Rückgänge sind hauptsächlich auf den Verlust des Lebensraums, des natürlichen Graslandes Nordamerikas, meist als Prärie bezeichnet, zurückzuführen. Da die Verbreitung der Art auf natürliches Grasland beschränkt ist. Historisch gesehen verschwanden die Vögel vollständig aus Gebieten, in denen die Landwirtschaft die natürliche Flora und Fauna verdrängte. Die Art kann auch empfindlich auf den Einsatz von Pestiziden in landwirtschaftlichen Betrieben reagieren. Sie werden auch häufig geschossen.[28][1]
Falknerei
Der Königsbussard wird zur Falknerei genutzt. Deutschsprachige Falkner verwenden auch den Namen Königsrauhfußbussard. Der Königbussard ist aufgrund seiner Größe, Kraft und aggressiven Persönlichkeit ein anspruchsvoller Greifvogel für Falkner, der nicht für Anfänger empfohlen wird. Für erfahrene Falkner bietet es die Möglichkeit, das nächste Äquivalent zur Jagd mit dem Steinadler zu erleben, wobei das Risiko einer Verletzung des Falkners durch den Falken wesentlich geringer ist.[33]
Literatur
- James Ferguson-Lees, David A. Christie: Raptors of the World. Houghton Mifflin, Boston 2001, ISBN 0-618-12762-3.
- C.M. White, P. Boesman und J.S. Marks, (2019): Ferruginous Hawk (Buteo regalis). In: Josep del Hoyo, A. Elliott, J. Sargatal, D. A. Christie, E. de Juana (Hrsg.): Handbook of the Birds of the World Alive. www.hbw.de, Lynx Edicions, Barcelona. Hochgeladen von https://www.hbw.com/node/53143 am 14. November 2019.
- J. Ng, M. D. Giovanni, M. J. Bechard, J. K. Schmutz, und P. Pyle (2017). Ferruginous Hawk (Buteo regalis), version 2.0. In: The Birds of North America (P. G. Rodewald, Editor). Cornell Lab of Ornithology, Ithaca, NY, USA. https://doi.org/10.2173/bna.ferhaw.02
- John B. Dunning Jr. (Hrsg.): CRC Handbook of Avian Body Masses. CRC Press, Boca Raton (Fl) 1992, ISBN 0-8493-4258-9.
- George Robert Gray: The genera of birds : comprising their generic characters, a notice of the habits of each genus, and an extensive list of species referred to their several genera. Band 1. Longman, Brown, Green, and Longmans, London 1849, S. 12 (Digitalisat).
Einzelnachweise
- Handbook of the Bird of the World
- Handbook of Avian Body Masses. S. 60
- Anm. Verf.: Die Angaben sind uneinheitlich. Das HBW bezeichnet ihn als größten Bussard; BNA nach dem Hochlandbussard als zweitgrößten. Die Angaben von Avian Body Masses legen auch aufgrund der Schwankungsbreite von Größe und Gewicht nahe, dass sich beide den ersten Platz teilen.
- Raptors of the World. S. 702
- BNA (Birds of North America) Introduction
- Raptors of the World. S. 703
- Martin J. Riesing, Luise Kruckenhauser, Anita Gamauf (†) und Elisabeth Haring: Molecular phylogeny of the genus Buteo (Aves: Accipitridae) based on mitochondrial marker sequences. In: Molecular Phylogenetics and Evolution 27 (2003) S. 328-342. doi:10.1016/S1055-7903(02)00450-5 Kruckenhauser & Gamauf et al.
- https://www.iucnredlist.org/species/22695970/93535999 IUCN-Redlist
- BNA Population Status~Numbers
- BNA Appearance
- BNA Locomotion
- BNA Molts
- BNA Vocalisations
- Stimmbeispiel - Revierruf
- Stimmbeispiel - Ruf in Nestnähe
- BNA Breeding Range
- BNA Overwintering Range
- BNA Timing an Routes of Migration
- BNA Habitat in Breeding Range
- Raptors of the World. S. 704
- BNA Home Range
- BNA Territoriality
- BNA Diet - Quantitative Analysis
- BNA Sexual Behavior
- BNA Breeding - Nest Site
- BNA Incubation and Hatching
- BNA Initial Dispersal from Natal Site & Fidelity to Breeding Site and Winter Home Range
- BNA Demography and Populations
- Neil D. Woffinden: History of the Naming of the Ferruginous Hawk: In: The Great Basin Naturalist 59(3),1999, Seiten 221-229 pdf. engl
- Joseph Grinnell: The two Check-Lists of 1931 - A critical Commentary. In: The Condor 34, Nr. 2, 1932 S. 88
- Avibase
- BNA Systematics - Related Species
- Frank Beebee: A Falconry Manual. Hancock House Publishers, Surrey 1984, ISBN 0888399782, S. 76.