Hinsberg-Trennung
Die Hinsberg-Trennung, auch Hinsberg-Reaktion genannt, ist nach dem deutschen Chemiker Oscar Hinsberg benannt. Die Trennung ist ein Verfahren in der organischen Chemie, um primäre, sekundäre und tertiäre Amine zu trennen oder in der qualitativen organischen Analyse zu deren Identifikation.[1][2]
| Sulfonsäureamide |
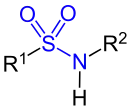 |
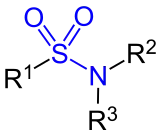 |
Anwendung
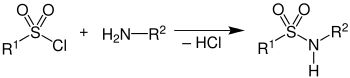
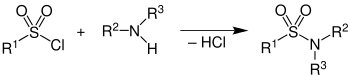
Die Umsetzung eines Amingemisches mit Benzolsulfonsäurechlorid[3] (oder – seltener – p-Toluolsulfonsäurechlorid[4]) in Gegenwart von Natriumhydroxid führt zur Bildung der entsprechenden Sulfonsäureamide (Sulfonamide). Die Amine reagieren dabei wie folgt:
- Primäre Amine bilden Sulfonsäureamide der Formel R-SO2-NHR, in denen der am Stickstoff gebundene Wasserstoff acide ist. Diese Sulfonsäureamide sind also Säuren und bilden nach der Reaktion mit Natronlauge in Wasser lösliche Natriumsalze.
- Sekundäre Amine bilden sehr schwer spaltbare Sulfonsäureamide der Formel R-SO2-NR2. Diese Produkte enthalten kein acides Wasserstoffatom, können also durch Natronlauge nicht deprotoniert werden und sind somit in Wasser unlöslich.
- Tertiäre Amine reagieren nicht mit dem Sulfonsäurechlorid.
Das unterschiedliche Verhalten der Amine ermöglicht so deren Trennung beziehungsweise Unterscheidung.
Reaktionsmechanismus
Einen möglichen Reaktionsmechanismus der dem Verfahren zugrunde liegt, beschreibt Zerong Wang in dem Buch Comprehensive Organic Name Reactions and Reagents.[5]

Im vorliegenden Beispiel werden Benzolsulfonsäurechlorid sowie ein primäres Amin verwendet. Im ersten Reaktionsschritt greift das Amin am Schwefelatom des Benzolsulfonsäurechlorids an. Es bildet sich das Zwischenprodukt 1. Aus diesem spaltet sich ein Chlorid-Ion ab, welches im nächsten Schritt am Anion 2 angreift. Unter Abspaltung von Chlorwasserstoff bildet sich ein Benzolsulfonsäureamid.
Weitere Anwendungen
Neben der analytischen Unterscheidung von primären, sekundären und teriären Aminen eignet sich das Verfahren ebenfalls zur gezielten Synthese sekundärer Amine aus primären Aminen:[5]
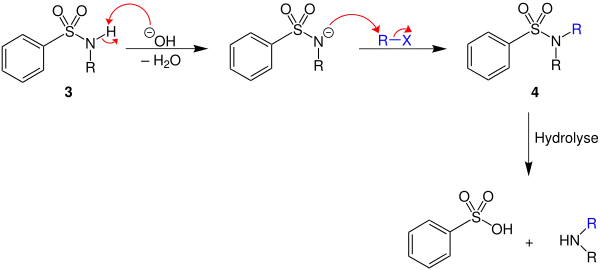
Das aus der Umsetzung von Benzolsulfonsäurechlorid und einem primären Amin erhaltene Benzolsulfonsäureamid 3 lässt sich durch Zugabe einer Base unter Wasserabspaltung deprotonieren. Gibt man ein Halogenalkan (R–X) hinzu, so bildet sich durch eine nukleophile Substitution das Benzolsulfonsäureamid 4. Aus diesem lässt sich mittels Hydrolyse Benzolsulfonsäure und das gewünschte sekundäre Amin darstellen.
Nachteile
Bei dem beschriebenen Verfahren zur Synthese sekundärer Amine aus primären Aminen handelt es sich um ein reines Laborverfahren. Aufgrund des Entstehens stöchiometrischer Mengen Abfallprodukte (u. a. Benzolsulfonsäure) weist dieses Verfahren eine schlechte Atomökonomie auf.[1][5]
Einzelnachweise
- O. Hinsberg: Ueber die Bildung von Säureestern und Säureamiden bei Gegenwart von Wasser und Alkali. In: Berichte der deutschen chemischen Gesellschaft. 23, Nr. 2, 1890, S. 2962–2965, doi:10.1002/cber.189002302215.
- O. Hinsberg, J. Kessler: Ueber die Trennung der primären und secundären Aminbasen. In: Berichte der deutschen chemischen Gesellschaft. 38, Nr. 1, 1905, S. 906–911, doi:10.1002/cber.190503801161.
- Hans Beyer, Wolfgang Walter: Organische Chemie. S. Hirzel Verlag, Stuttgart 1984, ISBN 3-7776-0406-2, S. 161.
- Siegfried Hauptmann: Organische Chemie. 2. Auflage, VEB Deutscher Verlag für Grundstoffindustrie, Leipzig 1985, ISBN 3-342-00280-8, S. 493.
- Zerong Wang: Comprehensive Organic Name Reactions and Reagents. John Wiley & Sons, New Jersey 2009, ISBN 978-0-471-70450-8, S. 1419–1421 (englisch).