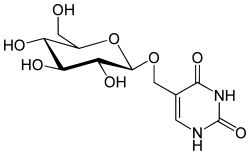
Glucopyranosyloxymethyluracil
D-Glucopyranosyloxymethyluracil ist eine Nukleinbase und leitet sich von Uracil ab. Die Kurzschreibweise für diese Base lautet „J“ (Base J). Sie wurde 1993 als Bestandteil nukleärer Desoxyribonukleinsäure (DNA) in Trypanosoma brucei, dem Erreger der afrikanischen Schlafkrankheit, identifiziert und ist die zuerst entdeckte hypermodifizierte Nukleinbase eukaryotischer DNA.[2]
| Strukturformel | |||||||
|---|---|---|---|---|---|---|---|
 | |||||||
| Allgemeines | |||||||
| Name | Glucopyranosyloxymethyluracil | ||||||
| Andere Namen |
| ||||||
| Summenformel | C11H18N2O8 | ||||||
| Externe Identifikatoren/Datenbanken | |||||||
| |||||||
| Eigenschaften | |||||||
| Molare Masse | 306,27 g·mol−1 | ||||||
| Sicherheitshinweise | |||||||
| |||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||
Vorkommen
D-Glucopyranosyloxymethyluracil wurde in allen bisher untersuchten Kinetoplastiden entdeckt, beispielsweise in Leishmanien (Leishmania donovani) oder Trypanosomen (z. B. Trypanosoma brucei, Trypanosoma cruzi, Trypanosoma borelli). Dies sind meistens parasitäre Verursacher verschiedener Krankheiten.
Die Base kommt auch in der marinen Flagellate Diplonema und in Euglena gracilis vor, einer einzelligen Alge. Dagegen konnte die Base in anderen Protozoen, Pilzen oder Wirbeltieren, z. B. im Menschen, nicht nachgewiesen werden.
Verbreitung innerhalb der DNA
β-D-Glucopyranosyloxymethyluracil tritt als Base J häufig in repetitive-DNA-Sequenzen beschriebener Organismen auf, häufig in den teleomeren Abschnitten. Im Durchschnitt werden in ungefähr 1 % des vorkommenden Thymins durch J ersetzt. Die Verteilung von J in teleomeren Abschnitten schwankt dabei in Abhängigkeit vom Organismus. In T. brucei kommt J zu 50 % darin vor, während in Euglena das meiste J dort nicht auftritt. Bei Crithidia fasciculata dagegen ist der Großteil, etwa 98 %, in den Telomeren lokalisiert.
Eine Besonderheit ist in T. brucei beobachtbar. Während der Phase, in der der Parasit im Zwischenwirt, der Tsetsefliege, lebt, wurde die Base J nicht detektiert. Andere Trypanosomen, wie T. cruzi oder L. donovani, enthalten D-Glucopyranosyloxymethyluracil dagegen in beiden Lebenszyklen.
Struktur
D-Glucopyranosyloxymethyluracil ist ein Glucosid. Hierbei ist D-Glucose über seine 1'-OH-Gruppe mit Hydroxymethyluracil glycosidisch verknüpft. In der DNA beschriebener Organismen wurde immer das β-Anomer der Glucose beschrieben.
Biosynthese
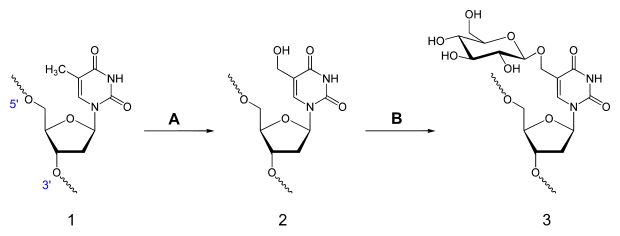
Im Organismus wird D-glucopyranosyloxymethyluracil in einer zweistufigen Reaktion aus Desoxythymidin in DNA (dT) synthetisiert (vgl. Bild). Hierbei erkennt eine Thymidinhydroxylase (TH, A in der Abbildung) Desoxythymidin (1) und oxidiert die Methylgruppe, so dass daraus Hydroxymethyldesoxyuridin (HOCH2-dU, 2) entsteht. Dieses wird anschließend zu β-D-Glucosyl-5-(hydroxymethyl)uracil (3) unter Verbrauch eines Moleküls D-Glucose umgesetzt, was eine Glucosyltransferase katalysiert (B).
Technische Darstellung
Die Base kann auch in der organischen Chemie dargestellt werden, beispielsweise ausgehend von 5-Hydroxymethyl-2-deoxyuridin (HOCH3-dU) oder Thymdine.[3]
J-Bindeproteine
JBP1
In Säugetieren wird methyliertes Cytosin (MeC) durch MeC-Bindeproteine erkannt, wodurch sich die Chromatinstruktur ändert. Analog dazu wurde ein J-Bindeprotein (JBP1) identifiziert, das die Base J erkennt und mit ihr interagiert. Damit gehört es zu den DNA-Bindeproteinen. In C. fasciculata ist dieses 90 kDa groß, homologe Proteine wurden auch in anderen Organismen entdeckt.
In vielen Kinetoplastiden ist die Menge an JBP1 sehr gering, was auf eine katalytische Funktion dieses Proteins hinweist. Für die Funktion von JBP1 wurde dabei vorgeschlagen, dass es bei der Biosynthese von J eine Rolle spielt. Hierbei soll es an J binden und dadurch die Glucosyltransferase zu benachbarten, bereits durch die Thymidinhydroxylase modifizierten Thyminbasen dirigieren. Dadurch wird die Anzahl von J in unmittelbarer Nachbarschaft aufrechterhalten.
Diese durch JBP1 vermittelte Aufrechterhaltung der Menge an J in der DNA wird durch eine Beobachtung in T. brucei gestützt. Falls dort das Gen für JBP1 inaktiviert wird, sinkt der Gehalt von J in der DNA auf 5 % im Vergleich zum Wildtyp. In Leishmania tarentolae und Leishmania major ist das Ausschalten des Gens sogar tödlich.
JBP2
In T. brucei wurde JBP2 identifiziert, ein 120 kDa schweres Homolog zu JBP1 entdeckt. Sein N-Terminus ist mit dem zu JBP1 zu 34 % identisch und zu 47 % ähnlich. Auch der C-Terminus weist analoge Übereinstimmungen mit dem von JBP1 auf (24 % identisch, 45 % ähnlich). Nur wenn sich der Parasit im Blutstrom eines Säugetiers aufhält, ist es exprimiert. Im Gegensatz zu JBP1 interagiert es aber nicht mit der DNA, so dass strenggenommen der Name falsch ist.
Auch in anderen, oben genannten Organismen wurde JBP2 entdeckt. Es wird diskutiert, ob JBP2 für die de novo und ortsspezifische Synthese von J wichtig ist. Hierbei könnten auch JBP1 und JBP2 zusammenarbeiten: Wenn T. brucei keines dieser Proteine exprimiert, kann dort die Base nicht mehr gebildet werden.
Biologische Bedeutung der Base
Die genaue Bedeutung der Base ist noch nicht bekannt. Anfangs vermutete man, dass die Base beim Gen-Silencing eine Rolle spielt – analog dazu, wie MeC in Wirbeltieren und Pflanzen Gene reprimieren kann. Neuere Untersuchungen sprechen aber dagegen.
Möglicherweise beeinflusst die Base die homologe Rekombination zwischen repetitiver Sequenzen, was auch für MeC anderer Eukaryoten vorgeschlagen wurde. Ob die Base eine Rolle in Bezug auf die Telomere ausübt, wird kontrovers diskutiert. Dafür spräche, dass in C. fasciculata oder manchen Leishmanien dort der größte Teil der Base aufzufinden ist. In anderen Spezies muss eine solch mögliche Funktion aber nicht unbedingt ausgeübt werden, beispielsweise in Euglena. Dort kommt nur ein Bruchteil von J in den Telomeren vor.
Da die meisten Kinetoplastiden, nicht jedoch ihre Wirte, diese Base enthalten, ist die Störung der Biosynthese ein Ziel für eine Parasit-spezifische Behandlung. Dies setzt jedoch voraus, dass zuerst die biologische Bedeutung der Base erkannt und verstanden wird.
Literatur
- Borst, P. und Sabatini, R. (2008): Base J: discovery, biosynthesis, and possible functions. In: Annu Rev Microbiol. 62; S. 235–251 (PMID 18729733; doi:10.1146/annurev.micro.62.081307.162750).
Einzelnachweise
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- Gommers-Ampt, JH. und Borst, P. (1995): Hypermodified bases in DNA, in: FASEB J, 9 (11); S. 1034–1042 (PMID 7649402; PDF).
- Martin de Kort, Edwin Ebrahimi, Eric R. Wijsman, Gijs A. van der Marel, Jacques H. van Boom (1999): Synthesis of Oligodeoxynucleotides Containing 5-(-D-Glucopyranosyloxymethyl)-2-deoxyuridine, a Modified Nucleoside in the DNA of Trypanosoma brucei, in: European Journal of Organic Chemistry, 1999(9), S. 2337–2344 (doi:10.1002/(SICI)1099-0690(199909)1999:9<2337::AID-EJOC2337>3.0.CO;2-F).