Gattermann-Reaktion
Die Gattermann-Reaktion, oder auch Gattermann-Methode ist eine Namensreaktion in der Organischen Chemie, welche 1890 erstmals von dem deutschen Chemiker Ludwig Gattermann (1860–1920) vorgestellt[1] und nach ihm benannt wurde. Sie beschreibt die Herstellung von aromatischen Halogeniden oder aromatischen Nitrilen durch Zersetzung entsprechender Diazoniumsalze in Gegenwart von Kupferpulver. Das Kupferpulver wird frisch aus einer wässrigen Kupfer(II)sulfat-Lösung gewonnen.[2]
Diese Reaktion eignet sich nicht für die Gewinnung von Fluoraromaten.[2]
Übersichtsreaktion
Bei dieser Reaktion wird ein instabiles Diazoniumsalz 1 unter Bildung eines Arylhalogenids 2 zersetzt. Es wird vermutet, dass diese Reaktion einen radikalischen Prozess einschließt, bei dem ein Elektronentransfer an der Oberfläche des metallischen Kupfers stattfindet.[2]
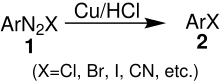
Reaktionsmechanismus
Es werden zwei verschiedene Reaktionsmechanismen diskutiert. Bei beiden Varianten steht das Kupfer am Ende der Reaktionskette wieder für neue Reaktionen zur Verfügung.[2]
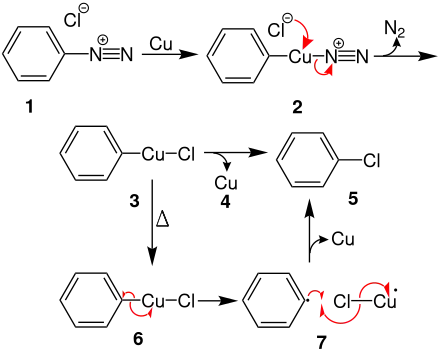
Reduktive Eliminierung von Kupfer
Bei der Reaktion von Diazonium-Salz 1 mit Kupfer, insertiert das Kupferatom zwischen den Phenylrest und die Diazogruppe. Aus der Zwischenstufe 2 bildet sich mit Chlorid unter Stickstoffabspaltung das Intermediat 3. Aus 3 wird das Kupfer 4 reduktiv eliminiert unter Bildung von Chlorbenzol 5.
Radikalischer Reaktionsmechanismus
Beim Erhitzen von 6 findet ein homolytischer Bindungsbruch zwischen dem Phenylrest und dem Kupferatom statt, wobei zwei Radikale entstehen, siehe 7. Anschließend wird durch radikalische Umlagerungen Kupfer abgespalten und Chlorbenzol 5 gebildet.
Modifikation
Bei einer modifizierten Gattermann-Reaktion erfolgt die Darstellung der Arylhalogenide aus Aryldiazoniumsalzen, die durch das Anion des o-Benzoldisulfonimids stabilisiert sind und getrocknet werden können.[3] Die Umsetzung dieser Aryldiazonium-o-benzoldisulfonimide mit quaternären Ammoniumhalogeniden in Gegenwart von Kupfer liefert Arylhalogenide.[2]
Beispielreaktion:
In diesem Beispiel wird zu einer Suspension von Benzoldiazonium-o-benzoldisulfonimid 1, in Acetonitril, Tetrabutylammoniumbromid 2 hinzugegeben. In Anwesenheit von Kupfer entsteht Brombenzol 3 als farbloses Öl mit einer Ausbeute von 86 %. Das Kupfer kann durch einfache Filtration entfernt und wieder verwendet werden.[2]
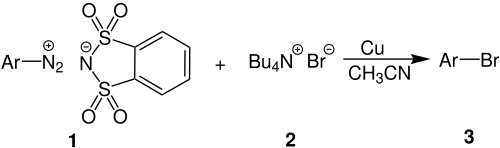
Verwandte Reaktionen
Diese Reaktion ist verwandt mit der Sandmeyer-Reaktion, der Balz-Schiemann-Reaktion und der Bart-Reaktion.[2] Besonders mit der Sandmeyer-Reaktion weist sie große Ähnlichkeit auf.[4]
Einzelnachweise
- Ludwig Gattermann: Untersuchungen über Diazoverbindungen. In: Berichte der deutschen chemischen Gesellschaft. 23, 1890, S. 1218, doi:10.1002/cber.189002301199.
- Zerong Wang: Gattermann Reaction. In: Comprehensive Organic Name Reactions and Reagents. John Wiley & Sons, Inc., Hoboken, NJ, USA 2010, ISBN 978-0-470-63885-9, doi:10.1002/9780470638859.conrr265.
- Margherita Barbero, Marco Crisma, Iacopo Degani, Rita Fochi, Paolo Perracino: New Dry Arenediazonium Salts, Stabilized to an Exceptionally High Degree by the Anion of o-Benzenedisulfonimide. In: Synthesis. Band 1998, Nr. 08, S. 1171, doi:10.1055/s-1998-2132.
- Carlo Galli: Radical reactions of arenediazonium ions: An easy entry into the chemistry of the aryl radical. In: Chemical Reviews. Band 88, Nr. 5, 1988, S. 765–792, doi:10.1021/cr00087a004.