Fráter-Seebach-Alkylierung
Die Fráter-Seebach-Alkylierung ist eine Namensreaktion der organischen Chemie. Diese wurde zum ersten Mal 1979 von Georg Fráter (1941–2019) beschrieben. 1980 berichtete Dieter Seebach (* 1937) von einer ähnlichen Reaktion mit einem Malat. Diese Synthese dient dazu, β-Hydroxyester in der α-Stellung stereospezifisch zu alkylieren.[1][2]
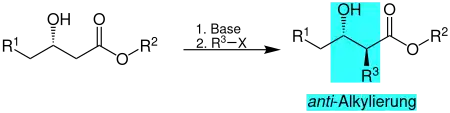
Übersichtsreaktion
Ein β-Hydroxyester lässt sich in der α-Stellung mit Hilfe einer starken Base und einem Halogenalkan diastereoselektiv alkylieren. Bei R2 und R3 handelt es sich um Kohlenwasserstoffreste. R1 kann des Weiteren einem Wasserstoff entsprechen.[2]
Allgemein
Bei der Fráter-Seebach-Alkylierung geht es um die asymmetrische Alkylierung von chiralen β-Hydroxyestern. Die Synthese bedarf je nach Reaktionsschritt einer Temperatur zwischen −78 °C und 10 °C. Als Lösungsmittel eignet sich Tetrahydrofuran (THF) sehr gut. Des Weiteren wird für die Reaktion eine sehr starke Base benötigt. Vorzugsweise werden hierfür Lithiumdiisopropylamid (LDA) oder Lithium-bis(trimethylsilyl)amid (LHMDS) genutzt.
Das anti-Produkt entsteht mit hoher Stereoselektivität, es entsteht nur ein sehr geringer Anteil an syn-Produkt.[1][2]
Reaktionsmechanismus
Es wird vermutet, dass der Reaktionsmechanismus der Fráter-Seebach-Alkylierung wie folgt aussieht. Im ersten Schritt wird die Hydroxygruppe des β-Hydroxyesters 1 von einer starken Lithium-Base deprotoniert. Es entsteht der Alkoholat-Ester 2. Im nächsten Schritt wird ein acides Wasserstoff an der α-Stellung durch eine starke Lithium-Base eliminiert. Es entsteht das Dianion 3. Unter Zugabe eines Halogenalkans kommt es nun zur Alkylierung in der anti-Position zum Alkoholat. Es entsteht der Alkoholat-Ester 4. Durch Protolyse entsteht der β-Hydroxyester 5.[3]

Variationen
Synthesevorgänge gemäß der Fráter-Seebach-Alkylierung lassen sich nicht nur mit Halogenalkanen durchführen. Die Reaktion kann des Weiteren auch zur Allylierung und Arylierung von β-Hydroxyester genutzt werden.[1][2]
Anwendung
Aufgrund der Diastereoselektivität und der hohen Ausbeute findet die Fráter-Seebach-Alkylierung immer wieder Anwendung. Die Ausbeute wird signifikant kleiner bei Alkylierungen mit längerkettigen Halogenalkanen. Des Weiteren ist die Ausbeute nicht nur von R2 abhängig, sondern auch stark von der Beschaffenheit von R1. Die Reaktion wird vor allem zur Herstellung von Naturstoffen und Inhibitoren genutzt.[4]
Einzelnachweise
- Dieter Seebach, Daniel Wasmuth: Herstellung von erythro‐2‐Hydroxybernsteinsäure‐Derivaten aus Äpfelsäureester. Vorläufige Mitteilung. In: Helvetica Chimica Acta. Band 63, Nr. 17, 1980, S. 197–200, doi:10.1002/hlca.19800630118.
- G. Fráter, U. Müller, W. Günther: The stereoselective α-alkylation of chiral β-hydroxy esters and some applications thereof. In: Tetrahedron. Band 40, Nr. 8, 1984, S. 1269–1277, doi:10.1016/S0040-4020(01)82413-3.
- Bradford P. Mundy, Michael G. Ellerd, Frank G. Favaloro: Name reactions and reagents in organic synthesis. 2. Auflage. John Wiley & Sons, New Jersey 2005, ISBN 0-471-22854-0, S. 252–253.
- Jessie H. Bird, Ashna A. Khan, Naoya Nishimura, Sho Yamasaki, Mattie S. M. Timmer, and Bridget L. Stocker: Synthesis of Branched Trehalose Glycolipids and Their Mincle Agonist Activity. In: The Journal of Organic Chemistry. Band 83, Nr. 15, 2018, S. 7593–7605, doi:10.1021/acs.joc.7b03269.