Feuerkopf-Saftlecker
Der Feuerkopf-Saftlecker (Sphyrapicus ruber) ist eine knapp buntspechtgroße nordamerikanische Spechtart aus der Gattung der Saftlecker (Sphyrapicus) innerhalb der Unterfamilie der Echten Spechte (Picinae). Der Feuerkopf-Saftlecker kommt vom südlichsten Alaska bis Südkalifornien nahe dem Pazifik in einem überwiegend recht schmalen Streifen vor und ist in seinem Verbreitungsgebiet nicht selten.
| Feuerkopf-Saftlecker | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|

Feuerkopf-Saftlecker (Sphyrapicus ruber) | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Sphyrapicus ruber | ||||||||||||
| (Gmelin, 1788) |
Feuerkopf-Saftlecker und Rotnacken-Saftlecker sind Schwesterarten, die gemeinsam mit dem Gelbbauch-Saftlecker eine Superspezies bilden. Bis 1983 wurden sie als Unterarten von Sphyrapicus varius, dem Gelbbauch-Saftlecker, angesehen.[1] Ihre Verbreitungsgebiete sind weitgehend klar voneinander getrennt, überlappen jedoch in einigen Regionen, in denen Hybride zwischen diesen Arten festgestellt werden, am häufigsten zwischen den beiden Schwesterarten.
Feuerkopf-Saftlecker sind mehrheitlich Standvögel oder Kurzstreckenzieher; sie ernähren sich, wie alle anderen Saftlecker auch, von Baumsäften, Insekten, Früchten und Beeren. Sie gehören zu den wenigen Spechtarten, die keinen Geschlechtsdimorphismus aufweisen. Häufig nisten in ihrer unmittelbaren Nachbarschaft Rotrücken-Zimtelfen, die einen Teil ihres Nahrungsbedarfes aus den Saftlöchern der Spechte decken.[2]
Die Art, von der zwei gut differenzierte Unterarten anerkannt werden, gilt als nicht gefährdet.[3]
Aussehen

.jpg.webp)

Der Feuerkopf-Saftlecker ist ein knapp mittelgroßer auffallend gefärbter Specht, der mit einer maximalen Körperlänge von 22 cm annähernd die Größe eines Buntspechts erreicht. Er ist jedoch bedeutend schlanker und graziler gebaut als dieser, sodass sein Gewicht nur zwischen 40 und 50 Gramm liegt. Die Art gehört zu den wenigen Spechten, die keinen Geschlechtsdimorphismus aufweisen, sodass eine Unterscheidung der Geschlechter im Feld nur aus dem Verhalten geschlossen werden kann. Die Artbestimmung sollte bei ausreichenden Beobachtungsbedingungen immer zweifelsfrei möglich sein. Schwieriger ist die Bestimmung der Hybride, die die Merkmale der Eltern in unterschiedlich starker Ausprägung aufweisen.
Bei Spechten der Nominatform sind Kopf, Brust und Nacken zinnoberrot. Im Brustbereich ist das Rot deutlich und scharf vom übrigen Bauchgefieder abgesetzt. Im Bereich der Augen sind schwarze Gefiederareale erkennbar, und ein gelblich-oranger, manchmal auch eher weißer Bartstreif verläuft in sehr unterschiedlicher Deutlichkeit von der Schnabelbasis bis unterhalb der Ohrdecken, ist aber oft nur angedeutet oder fehlt gänzlich. Die Basis des Oberschnabels ist deutlich weiß befiedert, die des Unterschnabels weist undeutlich schwarze Federareale auf. In unterschiedlicher Intensität können schwarze Federpartien insbesondere unterhalb der Ohrdecken erkennbar sein. Schultern, Rücken und Bürzel sind auf schwarzem Grund unregelmäßig hell gebändert, wobei diese Bänderung von den Schultern zum unteren Rücken von einem leichten Gelbton nach Weiß aufhellt und zwei markante, geflockt wirkende, annähernd parallel vom Schulterbereich zum unteren Rücken verlaufende Streifen bildet. Die oberen Schwanzdecken sind bis auf die weißen Spitzen schwarz. Die Schwanzfedern sind schwarz, nur das innere Paar ist weiß gebändert und die zwei Außenfedern weisen an den Außenfahnen zimtfarbige Aufhellungen auf. Die Flügel sind schwarz. Ausgedehnte weiße Areale im Bereich der Mittleren- und Großen Flügeldecken erzeugen das für alle Saftleckerarten charakteristische weiße, längliche Flügelfeld. Alle Arm- und Handschwingen sind an ihren Außenfahnen weiß gebändert und an der Spitze weiß gesäumt. Die Bauchseite ist schmutzig-weiß bis strohgelb und vor allem seitlich und an den Unterschwanzdecken pfeilspitzenartig dunkelgrau gezeichnet, bei manchen Individuen auch nur schwärzlich gestrichelt. Die Augen sind dunkelbraun. Schnabel, der unbefiederte Bereich der Füße sowie die Zehen sind schiefergrau.
Die Unterart S. r. daggetti unterscheidet sich von der Nominatform vor allem in der Zeichnung des Kopfes. In den meisten Fällen ist ein deutlicher, weißer Bartstreif in unterschiedlicher Länge zu erkennen. Voll ausgebildet erstreckt sich dieser, hakenförmig auslaufend, bis unter die Ohrdecken. Das Rot der Kopf-Nacken- und Brustfärbung ist weniger satt als bei S. r. ruber und geht im Bauchbereich fließend in das schmutzig weiß-gelbliche Bauchgefieder über. Im unterschiedlichen Ausmaß sind weiters schwarze Federschäfte im Kopf-, Nacken- und Kehlbereich erkennbar.
Die Geschlechter gleichen einander in allen wesentlichen Gefiedermerkmalen, in der Größe und im Gewicht. Der einzige, feldornithologisch allerdings meist nicht auswertbare Unterschied besteht darin, dass Weibchen meist eine etwas deutlichere und ausgedehntere Weißzeichnung des zentralen Paars der Schwanzfedern aufweisen.[5] Bei den Vögeln auf Haida Gwaii sind die Schnäbel der Männchen durchschnittlich 6 % länger als die der Weibchen.[6]
Der Flug ist der typisch bogenförmige Spechtflug mit einer Reihe kräftiger, schneller Flügelschläge in der Aufwärtsphase und zur Gänze angelegten Flügeln in der Abwärtsphase.
Mauser und Jugendgefieder
Die Jungen verlassen voll ins Jugendgefieder vermausert die Bruthöhle. Dieses Jugendgefieder weist im Wesentlichen die Zeichnungsverteilung des Adultgefieders auf, unterscheidet sich aber in den Farben. Vor allem sind die roten Partien des Erwachsenengefieders bei frisch flüggen Feuerkopf-Saftleckern dunkel-bräunlich mit einem leicht rötlichen Schimmer. Weniger auffallend ist die deutlichere schwärzliche Zeichnung des Bauchgefieders sowie der Anflug einer Bänderung im zentralen Rückenbereich. Die Mauser ins Erwachsenengefieder beginnt unmittelbar nach dem Ausfliegen und verläuft sehr rasch, sodass Jungspechte bereits im Spätsommer nur mehr schwer von adulten zu unterscheiden sind.[7]
Hybride
Der Feuerkopf-Saftlecker hybridisiert sowohl mit dem Gelbbauch-Saftlecker als auch mit dem Rotnacken-Saftlecker. Die Verbreitungsgebiete von Feuerkopf-Saftlecker und Gelbbauch-Saftlecker überlappen in einem kleinen Gebiet im nördlichen British Columbia, die von Feuerkopf-Saftlecker und Rotnacken-Saftlecker an vielen Stellen entlang ihrer Ost- beziehungsweise Westgrenze. Ebenso hybridisieren die beiden Unterarten vor allem im südlichen Oregon. Alle Hybride zeigen in unterschiedlicher Ausprägung und Deutlichkeit die Gefiedermerkmale der Eltern. Sie scheinen uneingeschränkt fertil zu sein und bringen uneingeschränkt fertile Nachkommen zur Welt.[8]
Lautäußerungen
Das Repertoire an Lautäußerungen der Art ist reichhaltig und individuell recht variabel. Akustisch am auffälligsten sind die Spechte in der Vorbrutzeit. Häufigster sowohl im territorialen als auch sexuellen Kontext geäußerter Ruf ist ein Kijeeh, das langgezogen klagend, aber auch kurz und scharf klingen kann (Stimmbeispiel Kiejeeh-Ruf[9]). In Auseinandersetzungen, zum Beispiel bei Revierstreitigkeiten, sind von beiden Geschlechtern gepresste, rau-schnalzende Laute zu hören, die im Englischen Waa-Calls genannt werden (Waa-Rufe[10]). Beide Geschlechter trommeln, das Männchen häufiger, lauter und länger. Die Trommelwirbel beginnen mit einer schnellen Folge, die mit Einzelschlägen oder kurzen, aussetzenden Elementen „tröpfelnd“ ausklingt (Trommeln auf einem Metalldach[11]).
Verbreitung und Lebensraum
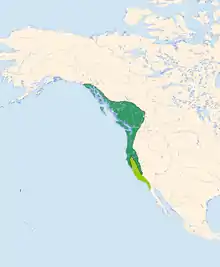
grün: Hauptverbreitungsgebiet.
hellgrün: Überwinterungsgebiet und einige punktuelle Brutvorkommen
Die nördlichsten Brutvorkommen des Feuerkopf-Saftleckers liegen in Südwestalaska und im Küsten- und Inlandsbereich von British Columbia und reichen ostwärts bis zur östlichen Kette des Kaskadengebirges; mit eingeschlossen sind die Kodiak-Insel, Vancouver Island und Haida Gwaii. Nach Süden umfassen sie etwa das westliche, pazifiknahe Drittel von Washington und von Oregon. In Kalifornien reicht das Verbreitungsgebiet im Norden bis zum westlichen Teil des Modoc County und südlich entlang des Küstengebirges bis Sonoma. Küstennah befindet sich noch eine disjunkte Population im Marin County. Im Kaskadengebirge reicht die Verbreitung südwärts bis in das Kern County. Daneben bestehen mehrere isolierte Vorkommen zum Beispiel am Mount Pinos, in den San Bernardino Mountains, im Bergland um San Diego und in den San Jacinto Mountains. Im Osten bestehen Verbreitungsinseln am Lake Tahoe und möglicherweise im Mohave County im westlichen Arizona. Als seltener Sommergast wurde die Art auch im Wallowa County im östlichen Oregon festgestellt.

Feuerkopf-Saftlecker brüten in recht unterschiedlichen Waldgesellschaften vom Meeresniveau bis in Höhen von 2900 m.[12] Bevorzugt werden Nadelwälder aus Gelb-Kiefer, Westlicher Weymouth-Kiefer, Küsten-Kiefer, Douglasien, Pracht-Tannen und verschiedenen Fichtenarten. In Niederungen und in flussbegleitenden Gehölzen brütet er in Zitterpappel- und Beständen anderer Pappel- und Weidenarten. Die Art kommt auch in großen Obstgärten sowie in anderen, stark anthropogen umgestalteten baumbestandenen Landschaften vor. Zur Anlage der Bruthöhlen ist ein gewisser Anteil von Totholz oder zumindest stark geschädigten Bäumen unerlässlich.
Im Winter halten sich Feuerkopf-Saftlecker häufiger in Laubwäldern oder dichter mit Laubbäumen bestandenen Gehölzen auf. Mischbestände mit Westlicher Balsam-Pappel, Rot-Erle sowie verschiedenen Ahorn-Arten werden oft aufgesucht, ebenso aber auch die dichten küstennahen Urwälder, deren Leitbäume die Douglasie und der Riesen-Lebensbaum sind. Auch im Winter liegt die vertikale Verbreitung der Art zwischen Meeresniveau und Höhen an die 3000 m.
Wanderungen
Feuerkopf-Saftlecker ziehen seltener und weniger weit als andere Saftlecker-Arten. Vögel der Nominatform sind mehrheitlich Standvögel. Weiter im Inland brütende Individuen ziehen an die Küste, Brutvögel der Gebirgslagen weichen in tiefer gelegene Regionen aus. Etwas höher ist die Zugbereitschaft bei der Unterart S. r. daggetti. Die im nördlichsten Areal brütenden Vögel verlassen im Herbst zur Gänze das Brutgebiet und ziehen meist küstennah oder entlang der Längstäler nach Mittel- und Südkalifornien, zum Teil auch bis in den nördlichen Bereich der Baja California.
Territorialität und Raumbedarf
In der Vorbrutzeit besetzen Feuerkopf-Saftlecker Reviere und zeigen ihren territorialen Anspruch vor allem durch Rufe und Trommeln an. Energisch verteidigt wird der Höhlenbaum selbst sowie einige Saftbäume im Zentrum des Reviers. Artgenossen und Höhlenkonkurrenten werden hier vehement attackiert. Zu anderen Saftleckern, insbesondere zum Kiefernsaftlecker, halten sie den gleichen Nestabstand ein wie zur eigenen Art. Zur Größe der Reviere liegen nur wenige Angaben vor: In British Columbia wurde eine mittlere Reviergröße von knapp 6 Hektar ermittelt.[13]
Nahrung und Nahrungserwerb
Wie alle Saftlecker ernähren sich Feuerkopf-Saftlecker sowohl von Baumsäften als auch von Insekten. Im Herbst und Winter sind Früchte, Beeren, Samen sowie Rindenbast wichtige Nahrungsbestandteile.
Zur Saftgewinnung beuten Feuerkopf-Saftlecker eine große Anzahl unterschiedlicher Nadel- und Laubbäume aus. Geschädigte Bäume oder solche, die bereits Saftlöcher aufweisen, scheinen bevorzugt zu werden. Wichtige Saftlieferanten sind unter anderen: Westamerikanische Hemlocktanne, Felsengebirgs-Tanne, Purpur-Tanne, Küsten-Kiefer, Jeffrey-Kiefer und Douglasien, und unter den Laubbäumen Rot-Erle, Papier-Birke, Oregon-Ahorn sowie verschiedene Weiden und Pappelarten. Früchte, Beeren und Samen spielen im Herbst und Winter eine wesentliche Rolle, vor allem Mehlbeeren (Sorbus sp.) sind ein wichtiger Energielieferant. Auch Rindenbast wird in dieser Zeit verstärkt aufgenommen.

Während des gesamten Jahres fressen Feuerkopf-Saftlecker Insekten, die sie entweder zufällig in den Saftlöchern vorfinden oder denen sie gezielt nachstellen. In der Vorbrut- und Brutzeit sind Insekten, insbesondere Ameisen, die wichtigste Nahrungsquelle. Sie stellen auch das Aufzuchtfutter der Jungen dar. Neben Ameisen spielen Fliegen, Blattläuse und Käfer eine gewisse Rolle. Feuerkopf-Saftlecker schlagen in radialen Ringen kleine, leicht nach oben geneigte Napflöcher bis in die baumsaftführende Schicht der Saftbäume. Gelegentlich hacken sie auch größere Flächen frei. Saftlöcher befinden sich vor allem im Stammbereich, seltener an starken, vertikalen Ästen. Den Baumsaft nehmen die Spechte mit meist seitlich geneigtem Kopf mittels der Zunge auf. Insekten erbeuten sie, indem sie die Rindenoberfläche absuchen, in Spalten und Ritzen stochern oder am Totholz größere Rindenstücke ablösen. Fluginsekten werden auch in kurzen Ausfallflügen gefangen. Gelegentlich tauchen Feuerkopf-Saftlecker die Nestlingsnahrung in Saftlöcher, bevor sie sie verfüttern.[15]
Brutbiologie
Feuerkopf-Saftlecker werden gegen Ende ihres ersten Lebensjahres geschlechtsreif. Die meisten brüten auch erstmals in diesem Alter. Die Paarbindung ist weitgehend monogam und erstreckt sich über eine Brutsaison. Auf Grund der hohen Ortstreue beider Geschlechter sind Wiederverpaarungen letztjähriger Brutpartner häufig. Feuerkopf-Saftlecker brüten einmal im Jahr. Bei frühem Gelegeverlust sind Ersatzbruten wahrscheinlich, jedoch nicht dokumentiert.
Balz und Höhlenbau
Die Balz beginnt unmittelbar nach Eintreffen der Weibchen im Brutgebiet und zeigt die spechttypischen Balzelemente, die auch im agonistisch motivierten Verhaltensrepertoire der Art vertreten sind. Der Revierbesitzer dokumentiert seinen Revieranspruch durch lautes Trommeln, durch Rufreihen und durch langsame Ausdrucksflüge innerhalb der Reviergrenzen. Er macht durch leichtes Klopfen auf Saftbäume und Höhlenbäume aufmerksam. Um die individuellen Aggressionsdistanzen abzubauen, sitzen die beiden Spechte einander unter Kopfschwingen, meist aber mit gesenktem Schnabel, gesträubtem Kopfgefieder und leicht gespreizten Flügeln gegenüber. Die Kopulationen beginnen in der ersten Phase des Höhlenbaus. Auch nach der Paarbildung halten die Partner einen relativ großen Individualabstand ein.
Der Höhlenbau beginnt in British Columbia in der letzten Aprildekade, in südlicher gelegenen Gebieten wahrscheinlich etwas früher. Der Höhlenbaum steht meist in unmittelbarer Nähe zu den Saftbäumen und anderen Nahrungsbäumen. In den allermeisten Fällen schlägt die Art ihre Bruthöhlen in Totholz oder in abgestorbene Teile noch lebender Bäume. Eine große Anzahl verschiedener Nadel- und Laubbäume kommt dafür in Frage. Die Höhlen befinden sich fast immer mindestens fünf Meter über dem Erdboden und können in Höhen von über 50 m liegen.[16] Die Hauptarbeit des Höhlenbaus erledigt das Männchen; Die Beteiligung des Weibchens ist individuell unterschiedlich und kann auch gänzlich entfallen. Je nach Substrat dauert der Konstruktionsprozess 6 Tage bis zwei Wochen, in Ausnahmefällen auch bis zu vier Wochen.[17]
Brut und Aufzucht der Jungen
Die Gelege enthalten 4–7 reinweiße, matt glänzende Eier in den durchschnittlichen Maßen von 23,6 × 18 mm. Sie werden in Tagesabstand gelegt. Die frühesten Gelege wurden in der letzten Aprilwoche festgestellt; der durchschnittliche Brutbeginn innerhalb des gesamten Verbreitungsgebietes liegt Mitte Mai. Frische Gelege sind noch bis in den Juni hinein zu finden. Zur Brutdauer fehlen genaue Angaben, sie dürfte aber mindestens 11 Tage, durchschnittlich jedoch 14 Tage betragen.[18] Nachts brütet wie bei fast allen Spechtarten das Männchen; während des Tages wechseln die Partner einander in recht kurzen Intervallen ab. Die Jungen schlüpfen innerhalb eines recht kurzen Zeitraumes, sodass die Entwicklungsunterschiede zwischen ihnen relativ gering sind. Sie werden von beiden Eltern gefüttert und gehudert. Auch die Entfernung der Kotsäcke besorgen beide Partner. Gelegentlich wurden nichtbrütende Artgenossen, aber auch Hybridspechte, an Bruthöhlen als Helfer festgestellt.[19] In der ersten Woche schläft das Männchen in der Bruthöhle. Die Entwicklung der Jungspechte erfolgt schnell. Mit 14 Tagen sind sie vollkommen befiedert. Das Nest verlassen sie zwischen ihrem 23. und 28. Lebenstag; sie sind zu diesem Zeitpunkt bereits ins Jugendgefieder vermausert und eingeschränkt flugfähig. Nach dem Ausfliegen versuchen die Eltern die Jungen zu Saftbäumen zu führen. Die Betreuung durch die Eltern hält noch einige Tage an, insgesamt ist die Führungszeit jedoch sehr kurz. Zur Dismigration der Jungspechte liegen keine Angaben vor.[20]
Bruterfolg, Lebenserwartung und Mortalität
Bezüglich Bruterfolg und Lebenserwartung gibt es keine detaillierten Daten. Wie alle kleinen und mittelgroßen Spechte sind auch Feuerkopf-Saftlecker eine häufige Beute verschiedener Greifvogelarten wie des Rundschwanzsperbers, des Eckschwanzsperbers oder des Habichts. Jungvögel und Eier gehören in das Beutespektrum einiger Marder, Hörnchen und Bären sowie baumkletternder Schlangen, insbesondere von Pituophis catenifer. Jungspechte verunglücken häufig in den ersten Tagen nach dem Ausfliegen und in besonders kalten Wintern, wenn die Baumsäfte nicht mehr fließen, kann es bei nicht ziehenden nördlichen Populationen zu sehr starken Bestandseinbußen kommen.[21][22]
Systematik
Der Feuerkopf-Saftlecker ist eine der vier Arten der Gattung Sphyrapicus, der Schwestergattung von Melanerpes. Die Gattung hat sich offenbar schon sehr früh in zwei Linien getrennt, in eine, die die S. varius - Superspezies mit Gelbbauch-Saftlecker (Sphyrapicus varius), Feuerkopf-Saftlecker und Rotnacken-Saftlecker (Sphyrapicus nuchalis) umfasst und eine zweite mit dem Kiefernsaftlecker (Sphyrapicus thyroideus) als einzigem Vertreter. Der Feuerkopf-Saftlecker und seine Schwesterart S. nuchalis spalteten sich zuletzt von S. varius ab.
Wahrscheinlich sind die gemeinsamen Vorfahren der Saftlecker Spechte der Gattung Melanerpes. Feuerkopf-Saftlecker und Rotnacken-Saftlecker galten lange als Unterarten des Gelbbauch-Saftleckers. Erst in der 6. Ausgabe der Checklist of North American Birds wurde 1983 die S.-varius-Gruppe in drei Arten gesplittet. Die AOU folgte damit den Erkenntnissen von Ned K. Johnson und Robert M. Zink, die erstmals auf den genetischen Abstand innerhalb der varius- Gruppe hinwiesen.[23]
Zurzeit werden zwei Unterarten anerkannt, die sich relativ deutlich durch die unterschiedliche Kopfzeichnung unterscheiden. Die Verbreitungsgrenze zwischen den beiden Unterarten liegt in einem recht breiten Gürtel im südlichen Oregon.[24]
Bestand und Bestandsentwicklung
Aktuelle, überregionale Bestandserhebungen liegen nicht vor. Kleinere Untersuchungen zeigen unterschiedliche Trends, einen leicht positiven in Oregon und einen leicht negativen in Kalifornien.[25] Im etwa 1 Mio km² großen Verbreitungsgebiet werden 3 Mio. reproduktionsfähige Individuen vermutet. Bestandseinbußen, die nach IUCN die Kriterien für die Aufnahme der Art in eine Gefährdungskategorie rechtfertigen würden, können zurzeit nicht festgestellt werden, deshalb gilt der Bestand des Feuerkopf-Saftleckers als nicht gefährdet und wird mit LC (=least concern) bewertet.[3]
Insgesamt ist die Bestandsgröße der Art relativ schwer zu bestimmen, da Feuerkopf-Saftlecker trotz ihrer relativ großen Brutortstreue für Jahre aus Gegenden verschwinden können, in denen sie zuvor häufig vorkamen, ohne dass klare Gründe für eine solche Fluktuation erkennbar wären.[26] Sensibel reagiert die Art auf moderne forstwirtschaftliche Maßnahmen, insbesondere auf die großflächige Entfernung von Totholz.
Einzelnachweise
- Walters et al. (2002) Introduction
- Walters et al. (2002) Introduction
- Factsheet auf BirdLife International
- Bestimmung durch Steven A. Shunk per e-mail, siehe auch: Recogniszing Hybrids (Memento des Originals vom 26. Juni 2012 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis. (PDF; 1,3 MB)
- Walters et al. (2002) Appearance
- Walters et al. (2002) Systematics
- Winkler et al (1995) S. 223
- Stephen A. Shunk: Sapsucker Hybrids. Recogniszing Hybrids (Memento des Originals vom 26. Juni 2012 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis. (PDF; 1,3 MB)
- Tayler Brooks: XC36976 (MP3) xeno-canto.org. 8. Juli 2009. Abgerufen am 7. April 2019.
- Andrew Spencer: XC76214 (MP3) xeno-canto.org. 20. April 2011. Abgerufen am 7. April 2019.
- Matt Goff: XC77313 (MP3) xeno-canto.org. 5. Mai 2011. Abgerufen am 7. April 2019.
- Walters et al. (2002) Habitat
- Walters et al. (2002) Spacing
- Bestimmung durch Steven A. Shunk per e-mail, siehe auch: Recogniszing Hybrids (Memento des Originals vom 26. Juni 2012 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis. (PDF; 1,3 MB)
- Walters et al. (2002) Food Capture and Consumption
- Walters et al. (2002) Breeding/Site Characteristics
- Walters et al. (2002) Breeding/Construction Process
- Walters et al. (2002) Young Birds/Growth and Development
- Walters et al. (2002) Cooperative Breeding
- Walters et al. (2002) Parental Care
- Walters et al. (2002) Predation
- Walters et al. (2002) Causes of Mortality
- Ned K. Johnson und Robert M. Zink: Speciation in Sapsuckers. (Sphyrapicus) I. Genetic Differentiation. In: Auk: Vol. 100, No. 4, October-December, 1983
- Winkler et al (1995) S. 223
- Walters et al. (2002) Population Status/Trends
- Walters et al. (2002) Population Regulation
Literatur
- Eric L. Walters, Edward H. Miller und Peter E. Lowther: Red-breasted Sapsucker (Sphyrapicus ruber). IN: The Birds of North America Online (A. Poole, Ed.). Ithaca: Cornell Lab of Ornithology; abgerufen auf Birds of North America Online 2002 [ohne Seitenangaben]
- Hans Winkler, David A. Christie und David Nurney: Woodpeckers. A Guide to the Woodpeckers, Piculets and Wrynecks of the World. Pica Press, Robertsbridge 1995, ISBN 0-395-72043-5, S. 68–69 und 223–224.
- Hans Winkler: Family Picidae (Woodpeckers) In: del Hoyo, Elliott und Sargatal (Hrsg.): Handbook of the Birds of the World. Bd. 7 (Jacamars to Woodpeckers) Lynx Ediciones Barcelona 2002 S. 274–419 und 452–453; ISBN 84-87334-37-7
Weblinks
- Videos, Fotos und Tonaufnahmen zu Sphyrapicus ruber in der Internet Bird Collection
- Sphyrapicus ruber in der Roten Liste gefährdeter Arten der IUCN 2013.2. Eingestellt von: BirdLife International, 2012. Abgerufen am 2. Februar 2014.