Einhorn-Acylierung
Über die Einhorn-Acylierung wurde erstmals im Jahr 1898 von Alfred Einhorn und Friedrich Hollandt berichtet. Es handelt sich hierbei um eine Acylierung von Alkoholen unter Verwendung von Anhydriden oder Carbonsäurehalogeniden in einem tertiären Amin wie Pyridin.[1] Die Einhorn-Acylierung ist eine Variante der Schotten-Baumann-Methode.[2]
Übersichtsreaktion
Ein sekundärer Alkohol wird in Gegenwart eines tertiären Amins wie Pyridin mit einem Carbonsäurehalogenid acyliert:[1]
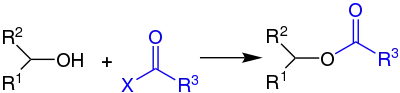
Das X kann hierbei ein Halogen, oder ein Ester-Rest sein. R2 und R3 können Alkyl- und Aryl-Reste, R1 kann ein Alkyl- und Aryl-Rest oder ein Wasserstoffatom sein.[1]
Reaktionsmechanismus
Bei dieser Reaktion fungiert das tertiäre Amin sowohl als nucleophiler Acylierungskatalysator, als auch als Säurefänger. So findet zunächst ein nucleophiler Angriff auf das Kohlenstoffatom statt, 1 während sich das Halogen abspaltet. Anschließend findet ein nucleophiler Angriff durch die Hydroxidgruppe des Alkohols statt 2. Dadurch kann sich das Pyridin wieder abspalten 3 und steht für die Aufnahme des Wasserstoffprotons bereit 5, welches sich vom kationischen Reagenz 4 abspalten lässt. Das alkylierte Produkt kann anschließend abgetrennt werden.[1]
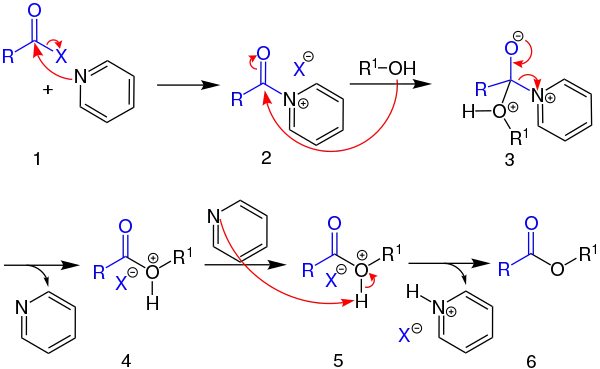
Der Beweis für einen nucleophilen Katalysator ist das Aufzeichnen des UV-Spektrums des intermediären Acetylpyridiumsalzes in Wasser. Als tertiäre Amine können z. B. Triethylamin, 4-(Dimethylamino)pyridin (DMAP), 1,4-Diazabicyclo[2.2.2]octan (DABCO) und 1,2,2,6,6-Pentamethylpiperidin (PMP) eingesetzt werden. Wenn zusätzlich chirale tertiäre Amine als Katalysator verwendet werden, können sekundäre Alkohole selektiv acyliert werden, um z. B. chirale Ester zu erhalten.[1]
Verwendung
Diese Reaktion findet breite Anwendung bei der Herstellung von Estern aus Alkoholen.[1]
Einzelnachweise
- Einhorn Acylation. In: Comprehensive Organic Name Reactions and Reagents. Wiley, 2010, ISBN 978-0-470-63885-9, S. 967–970, doi:10.1002/9780470638859.conrr209.
- Eintrag zu Einhorn-Reaktion. In: Römpp Online. Georg Thieme Verlag, abgerufen am 21. Februar 2019.