Drei-Finger-Toxine
Drei-Finger-Toxine (abgekürzt 3FTx) sind eine in Schlangengiften vorkommende Familie von nicht-enzymatischen Polypeptiden. Diese Toxine besitzen die Drei-Finger-Proteindomäne und gehören daher zu den Drei-Finger-Proteinen, die zwar alle eine ähnliche Proteinfaltung aufweisen, aber nicht alle giftig sind. Drei-Finger-Toxine bestehen meist aus etwa 60 bis 74 Aminosäureresten und besitzen in ihrem Kernelement drei β-Faltblätter, welche an einem zentralen Kern verbunden sind, der vier konservierte Disulfidbindungen enthält.[2][3] Trotz ihrer konservierten Struktur haben Drei-Finger-Toxin-Proteine eine große Bandbreite an pharmakologischen Wirkungen. Unter anderem haben sie neurotoxische, kardiotoxische und antikoagulative Eigenschaften. Die komplexe Beziehung zwischen dem biochemischen Aufbau und der Funktion der Drei-Finger-Toxine ist zum großen Teil Gegenstand der Grundlagenforschung. Die meisten Mitglieder der Familie sind Neurotoxine, die auf die cholinerge interzelluläre Signalgebung wirken; die Alpha-Neurotoxine interagieren mit den nikotinischen Acetylcholinrezeptoren (nAChRs), die Kappa-Bungarotoxine mit neuronalen nAChRs und Muskarin-Toxine mit Muskarin-Acetylcholinrezeptoren (mAChRs).[2]
| Erabutoxin A, ein Drei-Finger-Toxin | ||
|---|---|---|
| ||
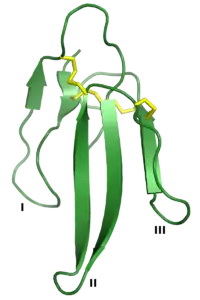
| Erabutoxin A, ein Neurotoxin der 3FTx-Familie. Die drei "Finger" sind mit I, II und III gekennzeichnet und die vier konservierten Disulfidbindungen sind gelb eingezeichnet.[1] | ||
| Masse/Länge Primärstruktur | 83 Aminosäuren, 9.137 Da | |
| Bezeichner | ||
| Externe IDs | ||
Struktur
Die Drei-Finger-Toxine sind durch eine gemeinsame Tertiärstruktur definiert, die aus drei β-Faltblatt enthaltenden Schleifen (den „Fingern“, bezeichnet als Schleifen I, II und III) besteht, die aus einem kleinen hydrophoben Kern mit vier konservierten Disulfidbindungen herausragen. Die Proteine sind typischerweise 60–74 Aminosäurereste lang, einige haben jedoch zusätzliche N- oder C-terminale Erweiterungen. Eine zusätzliche Disulfidbindung kann entweder in Schleife I oder Schleife II vorhanden sein.[2] Die Familie kann grob in drei Klassen eingeteilt werden:[2][4]
- kurzkettige Toxine haben unter 66 Aminosäurereste und vier Kern-Disulfidbindungen.
- langkettige Toxine haben mindestens 66 Aminosäurereste, eine Disulfidbindung in Schleife II und möglicherweise eine C-terminale Verlängerung.
- nicht-konventionelle Toxine haben eine Disulfidbindung in Schleife I und möglicherweise eine terminale Erweiterung.
Einzelnachweise
- V. Nastopoulos, P. N. Kanellopoulos, D. Tsernoglou: Structure of Dimeric and Monomeric Erabutoxin a Refined at 1.5 A Resolution. 1. September 1998, doi:10.1107/s0907444998005125, PMID 9757111 (englisch, nih.gov).
- R. Manjunatha Kini, Robin Doley: Structure, Function and Evolution of Three-Finger Toxins: Mini Proteins With Multiple Targets. November 2010, doi:10.1016/j.toxicon.2010.07.010, PMID 20670641 (englisch, nih.gov).
- Pascal Kessler, Pascale Marchot, Marcela Silva, Denis Servent: The Three-Finger Toxin Fold: A Multifunctional Structural Scaffold Able to Modulate Cholinergic Functions. doi:10.1111/jnc.13975, PMID 28326549 (englisch, nih.gov).
- Snake three-finger toxin family. In: venomzone.expasy.org. Abgerufen am 14. Januar 2020 (englisch).