Didemnine
Didemnine sind eine Klasse von tumorhemmenden, anti-proliferativen, anti-viralen sowie die Proteinbiosynthese hemmenden Substanzen, die zuerst aus Seescheiden (Ascidiacea) wie Trididemnum solidum extrahiert wurden. Ihre eigentliche Synthese ist jedoch höchstwahrscheinlich auf Bakterien zurückzuführen, da die dafür benötigten Gene (sog. did-Cluster) auf Plasmiden sowie die Didemnin-Synthese in den α-Proteobacteria Tistrella mobilis und Tistrella bauzanensis nachgewiesen wurden.[1][2]
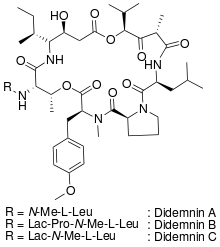
Chemisch zählen die Didemnine zu den Depsipeptiden und bestehen aus ringförmig geschlossenen, tlw. modifizierten Aminosäuren, an die weitere funktionale Gruppen oder Verbindungen anderer Klassen gebunden sind. Diese Peptide werden nicht von Ribosomen, sondern von Peptid-Synthasen synthetisiert. Didemnin B entsteht dabei vermutlich aus Vorläufermolekülen, die extrazellulär modifiziert werden.[1]
In einer Untersuchung des Wirkmechanismus des Didemnin B auf die Proteinbiosynthese konnte gezeigt werden, dass Didemnin B, neben anderen generell anti-proliferativen Wirkungen, effektiv den Translokationsmechanismus von eukaryotischen Ribosomen hemmt, indem es mit dem Elongationsfaktor EF-1 und Guanosindiphosphat (GDP) einen Komplex bildet, der an das Ribosom gebunden bleibt und dadurch die Translokation und die sukzessive Proteinverlängerung verhindert.[3] Aufgrund ihrer anti-proliferativen Eigenschaften wurden und werden einige der Didemnine als Krebsmedikamente erforscht. So wird bspw. eine nahe verwandte Verbindung des Didemnin B, das Dehydrodidemnin B (Aplidin, Plitidepsid), aus der Seescheide Aplidium albicans von dem spanischen Pharmaunternehmen PharmaMar S.A. erprobt.[2] Untersuchungen mit Didemnin B wurden aufgrund der hohen Cytotoxizität wieder eingestellt.[2]
Einzelnachweise
- Y. Xu, R. Kersten u. a.: Bacterial Biosynthesis and Maturation of the Didemnin Anti-cancer Agents. In: Journal of the American Chemical Society. 134, 2012, S. 8625–8632, doi:10.1021/ja301735a.
- M. Tsukimoto, M. Nagaoka u. a.: Bacterial Production of the Tunicate-Derived Antitumor Cyclic Depsipeptide Didemnin B. In: Journal of Natural Products. 74, 2011, S. 2329–2331, doi:10.1021/np200543z.
- B. SirDeshpande, P. Toogood: Mechanism of Protein Synthesis Inhibition by Didemnin B in Vitro. In: Biochemistry. 34, 1995, S. 9177–9184, doi:10.1021/bi00028a030.