Dialkylamine
Dialkylamine bilden eine Gruppe von organisch-chemischen Verbindungen, die sich von Ammoniak (NH3) ableiten, von dessen drei Wasserstoffatomen zwei durch Alkyl-Reste R ersetzt sind. Gelegentlich werden die Dialkylamine auch sekundäre Amine genannt.[1] Wenn die Reste R gleich sind, haben die Dialkylamine die allgemeine Formel HNR2. Ein bekanntes Dialkylamin ist das Diisopropylamin [R = CH(CH3)2].
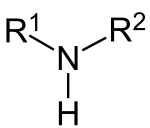
Dialkylamine sollten nicht mit Dialkylamiden – genauer N,N-Dialkylamiden – verwechselt werden.
Verwendung
Durch die Reaktion von Aldehyden oder Ketonen mit sekundären Aminen bilden sich unter Wasserabspaltung Enamine,[2] die bei der Knüpfung von Kohlenstoff-Kohlenstoff-Bindungen von Bedeutung sind, da diese leicht mit Elektrophilen (z. B. von Säurechloriden und aktivierte Alkylierungsmitteln wie Allylhalogeniden und α-Halogencarbonsäureestern sowie elektronenarmen Alkenen) reagieren.[3] Aus Diisopropylamin wird durch Umsetzung mit elementarem Lithium in Gegenwart von Styrol Lithiumdiisopropylamid (LDA) hergestellt.[4]
Dialkylamine reagieren mit Schwefelkohlenstoff zu Dithiocarbaminsäuren.[5]
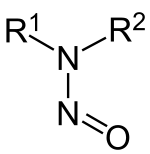
Dialkylamine reagieren mit salpetriger Säure zu Nitrosaminen, die häufig karzinogen wirken.
Einzelnachweise
- Otto-Albrecht Neumüller (Hrsg.): Römpps Chemie-Lexikon. Band 2: Cm–G. 8. neubearbeitete und erweiterte Auflage. Franckh'sche Verlagshandlung, Stuttgart 1981, ISBN 3-440-04512-9, S. 923.
- Eberhard Breitmaier, Günther Jung: Organische Chemie. 7. Auflage, Thieme Verlag, 2012, ISBN 978-3-13-541507-9, S. 325.
- Ludwig Gattermann, Heinrich Wieland: Die Praxis des organischen Chemikers. ISBN 3-11-006654-8.
- Manfred T. Reetz, Wilhelm F. Maier: Einfache Darstellung von Lithiumdiisopropylamid in molarem Maßstab. In: Liebigs Annalen. Nr. 10, 1980, S. 1471–1473, doi:10.1002/jlac.198019801002.
- Siegfried Hauptmann: Organische Chemie. 2. durchgesehene Auflage, VEB Deutscher Verlag für Grundstoffindustrie, Leipzig 1985, ISBN 3-342-00280-8, S. 494.