Cytochalasine
Cytochalasine sind bei vielen Pilzarten vorkommende Stoffwechselprodukte (Metabolite). In den Zellen eukaryotischer Lebewesen vermögen sie an Aktinfilamente zu binden. Dadurch wird die Polymerisation dieses Strukturproteins blockiert, in der Folge kommt es zu Änderungen der Zellgestalt (Zellmorphologie), Hemmung zellulärer Prozesse wie der Zellteilung oder sogar zum Zelltod (Apoptose).[1]
Eigenschaften
Cytochalasine haben die Fähigkeit, Zellmembranen zu durchdringen, zelluläre Translokation zu verhindern und Zellen zu enukleieren.[2] Cytochalasine können auch andere Aspekte biologischer Prozesse beeinflussen, die nicht mit der Aktinpolymerisation in Zusammenhang stehen. Zum Beispiel können Cytochalasin A und Cytochalasin B auch den Transport von Monosacchariden durch die Zellmembran hemmen,[2] Cytochalasin H reguliert das Pflanzenwachstum,[3] Cytochalasin D hemmt die Proteinsynthese[4] und Cytochalasin E verhindert die Angiogenese.[5]
Es ist bekannt, dass Cytochalasine an die mit Widerhaken versehenen, schnell wachsenden Plusenden von Mikrofilamenten binden, die dann sowohl den Zusammenbau, als auch die Zerlegung einzelner Aktinmonomere vom gebundenen Ende blockieren. Einmal gebunden, verschließen Cytochalasine im Wesentlichen das Ende des neuen Aktinfilaments. Ein Cytochalasin bindet hierbei an ein Aktinfilament.[2] Studien mit Cytochalasin D (CD) haben ergeben, dass die Bildung von CD-Aktin-Dimeren ATP-gebundenes Aktin enthält.[6] Diese CD-Aktin-Dimere werden als Ergebnis der ATP-Hydrolyse zu CD-Aktin-Monomeren reduziert. Das resultierende CD-Aktin-Monomer kann ein weiteres Monomer binden, um das CD-Aktin-Dimer zu reformieren.[2] CD ist sehr effektiv; nur geringe Konzentrationen (0,2 μM) sind erforderlich, um eine Membranzerkleinerung zu verhindern und das Treadmilling zu unterbrechen.[7] Die Auswirkungen von vielen verschiedenen Cytochalasinen auf Aktinfilamente wurden analysiert und höhere Konzentrationen (2–20 μM) von CD wurden benötigt, um Stressfasern zu entfernen.[7]
Im Gegensatz dazu hemmt Latrunculin die Aktinfilamentpolymerisation durch Bindung an Aktinmonomere.
Verwendung
Aktin-Mikrofilamente wurden unter Verwendung von Cytochalasinen umfassend untersucht. Aufgrund ihrer chemischen Natur können Cytochalasine den Forschern helfen, die Bedeutung von Aktin in verschiedenen biologischen Prozessen zu verstehen. Die Verwendung von Cytochalasinen hat es den Forschern ermöglicht, die Aktinpolymerisation, Zellmotilität, Kräuselung, Zellteilung, Kontraktion und Zellsteifigkeit besser zu verstehen. Aufgrund der Bedeutung von Cytochalasinen für das Verständnis der Bewegung des Zytoskeletts und vieler anderer biologischer Prozesse haben Forscher zwei synthetische Cytochalasine geschaffen.[1]
Cytochalasin hat praktische Anwendung in Thromboelastometrie (TEM) Vollblut-Assays zur Bewertung von Fibrinogen- und Fibrinpolymerisationsstörungen im FIBTEM-Assay auf ROTEM gefunden. Dieser Test basiert auf dem Prinzip, dass Cytochalasin D die Thrombozytenfunktion durch Hemmung der kontraktilen Elemente sehr effektiv inhibiert.[8] Die Plättcheninhibierung ist wirksamer als wenn Plättchen durch Glykoprotein-2b/3a-Hemmer blockiert werden.[9] In-vitro- und klinische Daten zeigen, dass die Gerinnungsstärke in FIBTEM unabhängig von der Thrombozytenzahl fibrinogenkonzentrationsabhängig ansteigt.[10] Daher können Fibrinogenmangel oder Fibrinpolymerisationsstörungen schnell nachgewiesen werden.
Chemische Strukturen
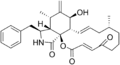 Cytochalasin A
Cytochalasin A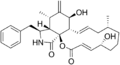 Cytochalasin B
Cytochalasin B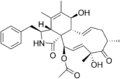 Cytochalasin C
Cytochalasin C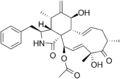 Cytochalasin D
Cytochalasin D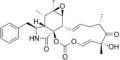 Cytochalasin E
Cytochalasin E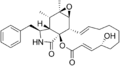 Cytochalasin F
Cytochalasin F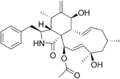 Cytochalasin H
Cytochalasin H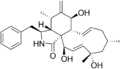 Cytochalasin J
Cytochalasin J
Siehe auch
Einzelnachweise
- A. M. Haidle und A. M. Myers: An Enantioselective, Modular, and General Route to the Cytochalasins: Synthesis of L-696,474 and Cytochalasin B. In: PNAS. Band 101, 2004, S. 12048–12053, doi:10.1073/pnas.0402111101.
- J. A. Cooper: Effects of Cytochalasin and Phalloidin on Actin. In: JCB. Band 105, 1987, S. 1473, doi:10.1083/jcb.105.4.1473.
- R. H. Cox et al.: Proton and Carbon-13 Nuclear Magnetic Resonance Studies of the Conformation of Cytochalasin H Derivatives and Plant Growth regulating Effects of Cytochalasins. In: J. Agric. Food Chem. Band 31, 1983, S. 405–408, doi:10.1021/jf00116a055.
- D. A. Ornelles et al.: Cytochalasin D releases mRNA from the Cytoskeletal Framework and inhibits Protein Synthesis. In: Mol. Cell Biol. Band 6, 1986, S. 1650–1652, doi:10.1128/MCB.6.5.1650.
- T. Udagawa et al.: Cytochalasin E, an Epoxide containing Aspergillus-derived fungal Metabolite, inhibits Angiogenesis and Tumor growth. In: J Pharmacol Exp Ther. Band 294, 2000, S. 421–427, PMID 10900214.
- D. W. Goddette und C. Frieden: Actin Polymerization. The Mechanism of Action of Cytochalasin D. In: J Biol Chem. Band 261, 1986, S. 15974–15980, PMID 7199055.
- I. Yahara et al.: Correlation between Effects of 24 different Cytochalasins on cellular Structures and cellular Events and those on Actin in vitro. In: JCB. Band 92, 1982, S. 69, doi:10.1083/jcb.92.1.69.
- J. A. May et al.: GPIIb-IIIa Antagonists cause rapid Disaggregation of Platelets pre-treated with Cytochalasin D. Evidence that the Stability of Platelet Aggregates depends on normal Cytoskeletal Assembly. In: Platelets. Band 9, 1998, S. 227–232, doi:10.1080/09537109876744.
- T. Lang et al.: Different Effects of Abciximab and Cytochalasin D on Clot Strength in Thrombelastography. In: Journal of Thrombosis and Haemostasis. Band 2, 2004, S. 147–153, doi:10.1111/j.1538-7836.2004.00555.x.
- T. Lang et al.: The Effects of Fibrinogen Levels on Thromboelastometric Variables in the Presence of Thrombocytopenia. In: Anesthesia & Analgesia. Band 108, 2009, S. 751–758, doi:10.1213/ane.0b013e3181966675.