Creophilus maxillosus
Creophilus maxillosus ist ein Käfer aus der Familie der Kurzflügler.[1] Die Gattung Creophilus ist in Europa nur mit dieser Art vertreten. Weltweit werden derzeit 16 Arten unterschieden. Creophilus maxillosus tritt in Europa in der Unterart Creophilus maxillosus maxillosus auf. Die hauptsächlich in Nordamerika auftretende Unterart Creophilus maxillosus villosus wurde früher als eigene Art Creophilus villosus geführt.[2]
| Creophilus maxillosus | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|

Creophilus maxillosus auf totem Wildschwein mit Fliege und Insektenlarven | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Creophilus maxillosus | ||||||||||||
| (Linnaeus, 1758) |
Der Käfer wird in der forensischen Entomologie zur Abschätzung des nach dem Tod vergangenen Zeitintervalls verwendet.
Bemerkung zum Namen
Es ist nicht verwunderlich, dass die auffällige und häufige Art bereits 1758 in der zehnten Auflage von Linnés Systema Naturae aufgeführt ist, in der erstmals die heute übliche binäre Nomenklatur verwendet wird.[3] Linné beschreibt die Art unter dem Namen Staphylinus maxillosus. Er gibt vier ältere Quellen an, beispielsweise wurde der Käfer bereits 1746 von Linné selbst als Staphylinus ater glaber, maxillis longitudine capitis (lat. schwarzer haarloser Staphylinus mit Maxillen von der Länge des Kopfes) beschrieben.[4] Der Namensteil maxillosus bezieht sich also auf die großen Maxillen (in Abb. 4 rot getönt). Diese Eigenschaft war jedoch höchstens zur Unterscheidung weniger Arten hilfreich, bei steigender Artenkenntnis ist die Maxillenlänge nicht mehr von diagnostischem Wert. Da Linnés Aussage Maxillen von der Länge des Kopfes nicht offenkundig ist, andererseits die Mandibeln (Abb. 9) deutlich länger sind als die Maxillen, wird in einem englischen Buch maxillosus undifferenziert als 'großkiefrig' (large-jawed) übersetzt und indirekt die Vermutung geäußert, dass Linné nicht die Unterkiefer, sondern die Oberkiefer gemeint hat.[5]
Im Band Der Käfersammler der Illustrierte(n) Taschenbücher für die Jugend wird der Käfer wegen des hellen Bandes auf den stark verkürzten Flügeldecken unter dem deutschen Namen 'Weisshaar-Halbflügler' abgebildet. Dieser Name hat sich jedoch nicht durchgesetzt.[6] In einem modernen Sachbuch trägt der Käfer den Namen 'Aas-Raubkäfer'.[7]
Der Name Staphylinus findet sich bereits 1634 in Muffets Theatrum Insectorum. Muffet unterscheidet dabei zwei verschiedene Staphylinus.[8] Noch in der neunten Auflage der Systema Naturae von 1756 unterscheidet Linné ebenfalls nur zwei Staphylinus.[9] In der zehnten Auflage zwei Jahre später dagegen trennt Linné die Gattung Staphilinus bereits in 19 Arten.[3] Als Autor der Gattung Creophilus gilt Leach 1819. Genauer betrachtet war es Samouelle, der 1819 veröffentlichte, dass er von Leach darüber informiert wurde, dass Kirby inzwischen die Gattung Creophilus mit dem Typus Creophilus maxillosus von der Gattung Staphylinus abgetrennt hatte.[10] Deswegen findet man als Autor der Gattung gelegentlich auch Samouelle oder Kirby angegeben.
Der Name Creōphilus ist von altgriechisch κρέας kréas ‚Fleisch‘ und φίλος phílos ‚Freund‘ abgeleitet[11] und spielt darauf an, dass man das Tier auf verrottendem Fleisch, insbesondere auf Äsern, findet (Taxobild).
Merkmale
.png.webp) | |
| Abb. 1: Aufsicht (tiefschwarzer Fleck auf Kopf und Halsschild ist Beleuchtungsartefakt) | |
 | |
| Abb. 2: Unterseite Creophilus maxillosus maxillosus | |
 | |
| Abb. 3: Seitenansicht Creophilus maxillosus villosus | |
 |
 |
| Abb. 4: Kopf von unten, teilweise getönt: rot: Unterkiefer, grün: Kie- fertaster, blau: Lippentaster, weiße Pfeilspitze: Zungenspitze | |
| Abb. 5: Mittelschiene | |
 |
 |
| Abb. 6: Detail Kopf ab Auge und Vorderecke Brustschild |
Abb. 7: Spitze des Fühlers |
 | |
| Abb. 8: Vorderschiene und Tarsus | |
 | |
| Abb. 9: rechter Oberkiefer von schräg oben/innen Umriss der drei Zähnchen blau, grün und pink | |
 | |
| Abb. 10: Wehrdrüsen ausgebreitet, Präparat, An- sicht von unten auf das Hinterleibsende, Sternite, Pleurite, Genitalien, Enddarm entfernt, mit Gewebe- resten; obere Hälfte teilweise durchscheinend kolo- riert, gelb: 8. Tergit, grün: 7. Tergit, rot: Gelenkhaut zwischen 7. und 8. Tergit: weiß: Wehrdrüse, Pfeil- spitze: Öffnung der Wehrdrüse. | |
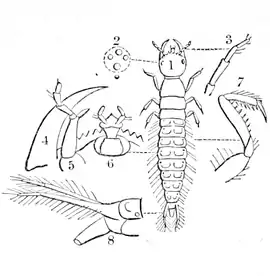 | |
| Abb. 11: Larve nach Westwood 1839[12] 1 Aufsicht, 2 Ozellen, 3 Fühler, 4 Mandibel, 5 Maxille mit Taster, 6 Lippe mit Lippentaster, 7 Bein, 8 letztes Abdominalsegment seitlich | |
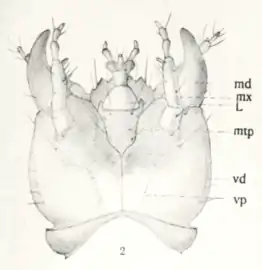 | |
| Abb. 12: Larvenkopf von unten nach Kemner[13] md (Mandibel) Oberkiefer, mx (Maxille) Unterkiefer, l (Labium) Unterlippe, mtp (Mentum) Kinn | |
 |
 |
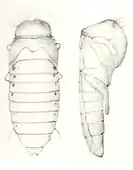
| Abb. 13: Puppe[13], links Aufsicht, rechts seitlich |
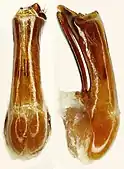
Abb. 14: Aedeagus Aufsicht und seitlich |
Der fünfzehn bis fünfundzwanzig Millimeter lange Käfer ist kaum zu verwechseln. Kopf und Halsschild sind glänzend schwarz, der Kopf nur an den Schläfen, der Halsschild nur am Seitenrand behaart (Abb. 6). Über die Flügeldecken, die den größten Teil des Hinterleibs frei lassen, läuft eine unscharf begrenzte, breite, gezackte Querbinde aus grauen Haaren mit schwarzhaarigen Flecken. Der Hinterleib ist oberseits scheckig weißlich oder gelblich grau behaart, die Unterseite des Hinterleibs ist bei Creophilus maxillosus maxillosus dicht überwiegend hell behaart (Abb. 2), bei Creophilus maxillosus villosus nur vorne hell, hinten dicht dunkel behaart (Abb. 3). Verschieden Varianten sind beschrieben worden, teilweise auch als Unterarten oder eigene Arten (anonymus Sulzer, arcticus Erichson, balteatus De Geer, bicinctus Mannerheim, canariensis Bernhauer, ciliaris Stephens, ciliaroides Hatch, cinearius Erichson, fasciatus Laporte de Castelnau, fulvago Motschulsky, imbecillus Sharp, medialis Sharp, nebulosus Geoffroy, orientalis Motschulsky, pulchellus Meier, sikkimensis Wendeler, subfasciatis Sharp).[2][1] Die genauere Unterscheidung der beiden Unterarten findet man bei Richardson,[14] einen Schlüssel für einige der Varianten bei Fauvel.[15]
Der Kopf ist hinten halsförmig abgeschnürt (Abb. 6). Bei Weibchen und schwächeren Männchen ist der Kopf abgerundet und verbreitert sich nach hinten (Abb. 2), bei starken Männchen ist er vor den Augen ebenso breit oder sogar etwas breiter als vor dem Hals (Abb. 1). Der Kopf ist oben mäßig dicht punktiert. Die großen ovalen Augen sitzen weit voneinander entfernt auf der Kopfoberseite. Sie sind fast flach und etwas schräg gestellt, vorn weiter voneinander entfernt als hinten. Die schnurförmigen Fühler sind schwarz und wenig länger als der Kopf. Sie sind elfgliedrig, die letzten fünf Glieder bilden eine gestreckte Keule, deren Glieder breiter als lang sind. Die ersten sechs Glieder sind glänzend und nur mit einzelnen abstehenden Haaren besetzt, die letzten fünf Glieder dicht pubeszent behaart und somit matt. Das Endglied ist deutlich länger als jedes der beiden vorausgehenden und endet konkav ausgeschnitten (nur bei entsprechender Ausrichtung sichtbar, wie in Abb. 7). Die Oberlippe ist breit und zweilappig (in Abb. 1 bei voller Vergrößerung gut erkennbar). Der linke Oberkiefer hat zwei kleine, etwa gleich große Zähne auf der Mitte des Innenrandes, die durch eine tiefe Kerbe getrennt sind. Der rechte Oberkiefer zeigt drei noch kleinere Zähne. Zwei liegen in Höhe der Schneide (in Abb. 9 grün und blau umrandet), der dritte liegt tiefer und ist in Aufsicht vom vorderen oberen Zähnchen verdeckt. Er wird erst sichtbar, wenn man mehr von innen betrachtet (in Abb. 9 pink umrandet). Der weiter hinter liegende obere Zahn (blau umrandet) ist bei starken Männchen deutlich mächtiger als die beiden anderen. Die Unterkiefer (in Abb. 4 rot getönt) tragen fadenförmige, viergliedrige Kiefertaster (in Abb. 4 grün getönt). Das Endglied ist kürzer als das dritte Glied. Die Unterlippe trägt eine ausgebuchtete, häutige Zunge (weiße Pfeilspitze in Abb. 4). Die daran dicht anliegenden, innen bewimperten, ledrigen Nebenzungen überragen die Zunge deutlich. Die dreigliedrigen Lippentaster (in Abb. 4 blau getönt) sind ebenfalls fadenförmig.
Der Halsschild ist deutlich breiter als lang. Die Vorderecken sind abgerundet. Zur Basis hin verschmälert sich der Halsschild und geht ohne erkennbare Hinterwinkel in die Basis über. Die Seitenränder sind sehr seicht ausgeschnitten. Seiten und Basis sind fein gerandet. Der Halsschild ist nur an den Rändern und dort sehr fein punktiert. Der hintere Teil der untergeschlagenen Seiten des Halsschilds (Epipleuren) ist so stark zurückgeschlagen, dass er selbst von der Seite betrachtet nicht sichtbar ist. In Abb. 2 sind lediglich bei der vorderen Hälfte des Halsschilds die Epipleuren als schmaler kahler Streifen erkennbar.
Die Flügeldecken sind gemeinsam etwas breiter als der Halsschild. Sie lassen die letzten sechs der acht Hinterleibstergite unbedeckt. Die Außenwinkel sind stark abgerundet, und sie treffen im stumpfen Winkel auf die Naht. Sie sind dicht mit etwa gleich langen kurzen Haaren bedeckt, aus denen mehrere vielfach längere Haare herausragen.
Die Hinterflügel sind voll entwickelt und funktionsfähig. In Ruhe werden sie mehrfach quer gefaltet unter den verkürzten Flügeldecken aufbewahrt.
Das Schildchen ist länger als breit und herzförmig dreieckig. Es ist dicht und stark punktiert und überwiegend grau behaart.
Die gescheckte Behaarung der Hinterleibsoberseite ist durch einen medianen schwarzen Mittelstreifen und kurze breite Querstreifen unterbrochen. Der Hinterleib endet abgerundet mit dem achten Tergit. Das neunte und zehnte Hinterleibssegment bilden die äußeren Sexualorgane und sind in den beiden Geschlechtern verschieden ausgebildet, zeigen aber in beiden Geschlechtern lang behaarte paarige Anhänge, bei getrockneten Exemplaren sind jedoch nur deren Spitzen sichtbar (Vergleiche Taxobild und Abb. 10 mit Abb. 1 und 2).
Hüfte, Schenkelring und Schenkel sind kurz schwarz behaart. Die Schienen sind lang stachelig behaart. Alle Schienen tragen auf der Unterseite zwei ungleich lange Enddornen, der deutlich längere liegt innen (Abb. 5). Bei den Vorderschienen sind die Enddornen jedoch zwischen einem Stachelkranz wenig auffällig. Die Tarsen sind fünfgliedrig. Die Tarsen der Vorderbeine sind rundlich erweitert (Abb. 6) und tragen unterseits ein Kissen aus Hafthaaren. Im Unterschied zur Gattung Staphylinus sind die Mittelhüften breit voneinander getrennt.[16][17][18]
Abbildung 14 zeigt das männliche Geschlechtsorgan (Aedeagus). Eine genauere Zeichnung und die Abbildung der weiblichen Genitalien findet man bei Clarke.[2] Eine sehr ausführliche Beschreibung des adulten Käfers mit vielen Detailzeichnungen findet sich bei Blackwelder.[19]
Entwicklungsstadien
Ei
Das Ei hat eine Länge von zwei bis drei Millimetern bei einer Dicke von 1,5 bis zwei Millimetern. Es ist dünnschalig, opak und weiß bis cremefarbig.
Larvenstadien
Die Larve wurde bereits 1839 von Westwood mit genauen Details gezeichnet (Abb. 11), allerdings war sich der Autor nicht darüber im Klaren, ob es sich dabei um die Larve von Goerius olens oder von Creophilus maxillosus handelte.[12] Diese Unsicherheit wurde 1912 von Kemner dahingehend entschieden, dass es sich zweifelsfrei um die Larve von Creophilus maxillosus handelt. Kemner beschrieb die Larve erneut und ausführlicher.[13]
Die frisch geschlüpfte Larve erreicht eine Länge von 5,5 bis sechs Millimetern bei einer Breite von 1,2 bis 1,5 Millimetern. Im letzten Stadium (Bilder im Netz[20]) ist sie fünfundzwanzig bis dreißig Millimeter lang und fünf bis sieben Millimeter dick. Sie wird im Folgenden beschrieben.
Der Kopf ist rundlich und platt. Auf jeder Seite befinden sich vier Ozellen (Abb. 11, Detail 2). Die dreigliedrigen Fühler (Abb. 11, Detail 3) entspringen weit vorn, fast zwischen den Mandibeln (Abb. 11, Detail 4 und Abb. 12, md). Sie sind knapp zwei Millimeter lang. Der Bau der Maxille (Abb. 11, Detail 5 und Abb. 12, Mx) und der Unterlippe mit Lippentaster (Abb. 11, Detail 6 und Abb. 12, L) kann den Abbildungen entnommen werden.
Die Rückenseite des ersten Brustsegments ist breit, dunkel und stark sklerotisiert. Die Bauchseite ist nur vorn sklerotisiert. Die Bauchplatte ist dreieckig mit einem Anhang. Mittel- und Hinterbrust sind zueinander ähnlich gebaut: Ihre Rückenplatten sind wenig breiter als die des ersten Brustsegments, aber deutlich kürzer. Sie sind längs zweigeteilt und bilden einen Spalt von 0,1 Millimetern. Die Bauchseite des zweiten und dritten Brustabschnitts ist nicht sklerotisiert. Bei allen drei Rückenplatten des Brustabschnittes ist hinten ein schmaler sklerotisierter Streifen abgesetzt.
Mit Ausnahme des Endglieds haben alle Hinterleibssegmente auf dem Rücken zwei deutlich voneinander getrennte, nebeneinander liegende Platten, auf dem Bauch zwei sechseckige nebeneinander liegende Platten und auf den Seiten zwei Platten, die obere größer und länglich, die untere kaum kleiner. Alle diese acht Platten sind matt braun und sehr spärlich behaart. Das letzte Abdominalsegment (Abb. 11, Detail 8) ist dunkler, überall stark sklerotisiert und behaart. Es trägt zwei dreigliedrige, jeweils etwa drei Millimeter lange Cerci. Das mittlere Glied ist deutlich kleiner als die beiden anderen. Die beiden Cerci entspringen am Ende des Rückens und stehen nach hinten und oben ab. Auf der Bauchseite trägt das letzte Abdominalsegment eine zwei Millimeter lange röhrenförmige Verlängerung, durch die der Verdauungstrakt entleert.
Die sechs Beine sind alle gleich gebaut (Abb. 11, Detail 7). Die Hüfte ist groß, lang und an der Basis breit. Der Schenkelring schließt schräg an den Schenkel an. Der Schenkel ist ein Millimeter lang und verbreitert sich zur Schiene hin. Die gleich lange Schiene ist sehr schmal. Der Fuß besteht nur aus einer kräftigen Kralle. Alle Teile des Beines sind stachelig behaart, an der Schiene sind die Haare in zwei Reihen angeordnet.
Der Brustabschnitt trägt seitlich ein großes Stigma im mittleren und ein kleines Stigma zwischen dem zweiten und dritten Beinpaar. Die Stigmen des Hinterleibs werden nach hinten kleiner. Alle Stigmen sind dunkel sklerotisiert.[13][21][12]
Puppe
Die Puppe (Abb. 13) ist fünfzehn Millimeter lang bei einer Breite von fünf Millimetern an der breitesten Stelle. Sie ist anfangs durchscheinend hellbraun und wird dann schwarz. Beine, Hinterflügel und Kiefer sind gegen den Bauch gefaltet. Die Fühler kreuzen unter den Augen die Oberkiefer. Dahinter sind sie aufeinander zulaufend und dann nach vorn zurückgebogen. Die Flügeldecken liegen über den Hinterflügeln und schmiegen sich nach hinten und unten gekrümmt dem Körper an, bedecken aber die Hinterflügel nur teilweise. Der Hinterleib ist oben flach und an den Seiten scharf gekantet. Auf ihm liegen die dunklen Stigmen auffällig erhöht an den Außenseiten der Hinterleibssegmente (Bild im Netz[22]). Auf dem vorderen Teil des Halsschilds verläuft quer ein auffälliger, schmaler Grat, auf dem in gleichen Abständen eine Reihe von Einzelhaaren sitzt (in Abb. 13 bei Vergrößerung gut erkennbar).[21]
Biologie
Vorkommen
Die Käfer findet man hauptsächlich auf Aas, das in offenem Gelände liegt. Aber auch in bewaldeten Gebieten wird Aas angeflogen. An feuchten Stellen liegende Kadaver werden gegenüber solchen an trockenen Stellen bevorzugt, ebenso größere Kadaver gegenüber kleinen. Ebenfalls häufig findet man die Käfer an Misthaufen. Bei einer Studie im Kaukasus wurde der Käfer durchgehend in allen Höhenstufen von der Ebene bis zur Nivalzone nachgewiesen.[23]
Der Käfer ist ganzjährig anzutreffen. Die beiden Häufigkeitsmaxima liegen im Frühsommer einerseits und im Frühherbst andrerseits. Nachts ist der Käfer besonders aktiv.[21]
Nahrung, Nahrungsaufnahme
Zum Auffinden des Aases werden beträchtliche Distanzen überwunden. Das Aas wird hauptsächlich im Flug lokalisiert, der Geruch von Aas in der Nähe lockt die Tiere aber auch direkt aus ihren unterirdischen Verstecken an und die Käfer nähern sich dann mit Hilfe der Beine.
Die Hauptnahrung der Käfer sind Fliegenlarven, die sich im Aas entwickeln. Das Aas von Fischen, Fröschen, Schildkröten, Schlangen, Eidechsen, Vögeln, großen und kleinen Säugetieren dient dabei gleichermaßen als Substrat für die gejagten Fliegenlarven. Nach Hungerphasen in Gefangenschaft reagieren die Käfer sichtlich nervös, wenn Fliegenlarven in den Käfig gegeben werden. Der Geruch spielt demnach eine Rolle beim Aufspüren der Opfer. Es können dann vom hungrigen Käfer in schneller Folge bis über zehn Larven verzehrt werden. Die Larve wird mit den Oberkiefern ergriffen, die Larvenhaut wird mit den Kiefern durchtrennt, und der Käfer hält die Larve zusätzlich mit den Vorderbeinen, während er auf dem mittleren und hinteren Beinpaar steht. Dann wird die Larve mit den Kiefern nach vorn und hinten durchgeknetet, bis die dadurch entstandene breiige Masse aufgenommen wird. Übrig bleibt das Exoskelett der Larve. Bei sehr großen Larven legen sich die Käfer beim Fressen auch gern auf die Seite.
Bei Fütterungsversuchen in Gefangenschaft fressen hungrige Käfer auch lebende Ameisen, Termiten, Regenwürmer, flugunfähige Fliegen. Sie greifen die Beute an, halten sie mit den Vorderbeinen fest, knacken das Exoskelett der Beute mit den Oberkiefern und verspeisen dann die freigelegten Weichteile.
Auch Larven der eigenen Art werden gefressen. Die ersten beiden Larvenstadien können sich gewöhnlich wegen ihrer geringen Größe bei Angriffen in die oberen Bodenschichten verkriechen. Große Larven im dritten Larvenstadium versuchen, sich mit den Oberkiefern gegen angreifende adulte Käfer zu verteidigen. Dies gelingt jedoch nicht immer. Es wurde beobachtet, dass zwei Käfer gleichzeitig eine Larve angriffen und diese letztendlich in zwei Teile zerrissen. Jeder Angreifer zog sich dann mit seiner Hälfte zurück und verspeiste sie. Im Streit über eine Beute greifen sich adulte Tiere auch gegenseitig an, wobei sie sich erheblich beschädigen können. Wenn im Käfig schließlich der schwächere Käfer vom stärkeren verspeist wird, ist dies möglicherweise immer darauf zurückzuführen, dass der schwächere auf Grund des Platzmangels im Käfig nicht genügend Ausweichmöglichkeiten findet.
Das Aas selbst wird nur bei größter Nahrungsnot der Käfer als Nahrungsquelle benutzt. Fliegenlarven werden jedoch bevorzugt, die Anwesenheit von Fliegen bewegt die Käfer sofort, die Aufnahme von Aas zu unterbrechen. Der Käfer unterscheidet bei der Wahl seiner Beute jedoch auch zwischen verschiedenen Fliegenarten. So zeigte sich in einer Versuchsreihe, dass der Käfer Larven der Fliegenart Cochliomyia macellaria gegenüber den Larven von Chrysomya rufifacies bevorzugt fraß. So wurden von ihm getötete Cochliomyia macellaria-Larven nur zu 4,8 % nicht verspeiste, von den Chrysomya rufifacies-Larven dagegen wurde fast jede vierte Fliegenlarve verschmäht, obwohl sie zuvor vom Käfer getötet worden war. Außerdem wurde die weniger bevorzugte Madenart etwas über 42 % gar nicht erst angegriffen, von den Maden von Cochliomyia macellaria dagegen nur knapp 32 % verschont. Im Untersuchungsgebiet, in dem Cochliomya macellaria heimisch ist, Chrysomya rufifacies dagegen invasiv vorkommt, meidet Creophilus maxillosus in der Natur Aas, das vorwiegend von Chrysomya rufifacies besiedelt ist.[24]
Die Larven des Käfers ernähren sich ausschließlich von Fliegenlarven.[21][25]
Verwendung in der Forensik
Die Anwesenheit der Käfer an Leichen wird in der forensischen Entomologie dazu benutzt, den Todeszeitpunkt einzugrenzen. Dabei gehört der Käfer zu den spät anzutreffenden Arten. Zwar kann man auch bereits wenige Stunden nach dem Tod einzelne Exemplare des Käfers anfliegen sehen, aber für die Forensik wird untersucht, wann der Käfer gehäuft auftritt oder wann erstmals Larven oder Puppen gefunden werden und wie lange Larven an einem Kadaver anzutreffen sind.[26][27] In einer ausführlichen Studie, in der verschiedene Waldtypen und verschiedene Jahreszeiten in zwei Jahren verglichen wurden, zeigte sich, dass an ausgelegten Schweinekadavern Larven von Creophilus maxillosus über beide Jahre und drei Waldtypen gemittelt im Frühjahr durchschnittlich an 21 Tage alten Kadavern, im Sommer bereits an sieben Tage alten Kadavern und im Herbst an 12 Tage alten Kadavern erschienen. Über die Jahreszeiten gemittelt erschien die Larve im Kiefer-Eichenwald an 23 bis 25 Tage altem Aas, im Hainbuchen-Eichenwald an 26 bis 28 Tage altem Aas, im Erlenwald schon an 18 bis 20 Tage altem Aas. Die Ergebnisse hängen jedoch auch vom Jahr ab. Über Waldtypen und Jahreszeiten gemittelt erschienen die Larven 2006 nach 13 bis 15 Tagen am Aas, im folgenden Jahr dagegen erst an 18 bis 20 Tage alten Äsern. Neben dem Erstauftreten wurde die Länge des Auftretens untersucht. Im Frühjahr sind die Larven durchschnittlich etwa 35 Tage lang aufzufinden, im Sommer dagegen nur zehn Tage lang.[28] Im Vergleich von ungeschädigten Schweinekadavern und durch Brand schwer geschädigten Schweinekadavern, der einmal im Sommer, einmal im Winter durchgeführt wurde, erschien Creophilus maxillosus im Winter nach etwa vier Wochen lediglich am verbrannten Schwein, im Sommer bei den verbrannten Schweinen früher als bei den unverbrannten.[29]
Das Zeitintervall, das bis zum Auftreten des Käfers beziehungsweise seiner Larven am Kadaver verstreicht (Preappearance interval PAI, in Tagen gemessen), lässt sich annähernd durch eine Exponentialfunktion der Temperatur T in °C beschreiben (). Eine konkrete Versuchsreihe lieferte folgende Ergebnisse: Wenn man für c das kürzestes Zeitintervall einsetzte, nach dem der Käfer beziehungsweise seine Larve am Kadaver angetroffen wurde, ergab sich für die Larve von Creophilus maxillosus c = 7,3; durch Regression erhielt man für a und b die Werte a = 7,432066 und b = 0,312329. Für die adulten Tiere erhielt man entsprechend mit c = 2,4 für die Parameter a = 8,149812 und b = 0,377601. Wurden alle drei Parameter a, b, und c durch Regression ermittelt, erhielt man in beiden Fällen ein größeres c.[30][30] Eine weitere Untersuchung zeigt, dass bei Creophilus maxillosus die Zeitspanne seit dem Tod bei bekannten Temperaturverhältnissen auch durch die Größe des geschlüpften fertigen Insekts besser eingeschätzt werden kann, noch genauer, wenn man Männchen und Weibchen getrennt betrachtet. Bei vorgegebener Temperatur brauchen größere und schwerere Tiere weniger Zeit für die einzelnen Entwicklungsschritte als kleinere, leichtere Tiere.[31]
Thanatose
Sowohl die Larve als auch der Käfer können sich tot stellen (Thanatose). Sie biegen den Hinterleib dabei nach unten und vorn, so dass der Körper einen Ring formt. Diese Haltung wird aber nur nach einer plötzlichen Störung und nur für wenige Sekunden eingenommen. Bei Wiederholung des auslösenden Reizes unterbleibt die Thanatose.[21]
Wehrdrüsen
Insbesondere die letzten Segmente des Hinterleibs kann der Käfer wie ein Teleskop ineinander schieben. Dies wird ermöglicht, weil die sklerotisierten Teile durch Gelenkshäute verbunden sind. Das letzte, über dem Anus liegende Tergit wird hier als achtes Tergit bezeichnet. (Die Nummerierung ist nicht einheitlich.) Die Gelenkhaut zwischen dem siebten und achten Segment (in Abb. 10 rot) ist hinten am Vorderrand des achten Tergits (in Abb. 10 gelb) angewachsen, vorn aber deutlich vor dem Hinterrand des siebten Tergits. Die paarigen Wehrdrüsen (in Abb. 10 weiß) erinnern in ihrer ausgebreiteten Form an den unteren Teil einer Strampelhose. Sie münden dicht nebeneinander durch die Gelenkhaut zwischen dem siebten und achten Tergit nach außen (Pfeilspitze in Abb. 10). Im lebenden Zustand sind die Drüsen so verkürzt, dass sie sich im Wesentlichen unter dem siebten Tergit befinden.
Am distalen Ende der Wehrdrüsen ist dicht gepacktes Drüsengewebe als Streifen seitlich an die Drüsenwand angelagert. Auch im mittleren Bereich befinden sich noch einige Flecken mit Drüsengewebe. Das Drüsengewebe sezerniert eine Mischung verschiedener chemischer Substanzen mit abschreckender Wirkung nach innen. Die Substanzen werden hauptsächlich im mittleren und basalen Teil des Drüsensacks in ausgefällter Form gespeichert. Wenn der Käfer, beispielsweise durch Zwicken, stark gereizt wird, richtet er den Hinterleib auf und presst ihn zusammen. Dadurch wird der Druck der Lymphe erhöht, was wiederum die beiden Drüsen nach außen drückt. Dabei stülpen sich die basalen Teile der Drüse, vergleichbar mit einem Darmvorfall, nach außen um. So gelangt als erstes der im basalen und mittleren Bereich gespeicherte Inhalt in Form von weißlichen Substanzen auf die Außenseite. Unmittelbar danach scheidet der Käfer aus dem Darm einen Flüssigkeitstropfen aus, wodurch die Substanzen über die gesamte Spitze des Hinterleibs verteilt werden. Nun schlägt der Käfer mit der Hinterleibsspitze gegen den Störenfried. Der Käfer kann dabei den Hinterleib über 90° nach oben schlagen. Ebenso kann der Hinterleib nach unten eingeschlagen werden, wobei er fast den Kopf erreicht. Außerdem ist eine gewisse seitliche Ablenkung des Hinterleibs möglich. Zur Verstärkung der Abwehr wird häufig auch der Darm entleert. Im Versuch wurde gezeigt, dass zumindest die Ameisenart Formica exsectoides effektiv abgewehrt werden kann.[32]
Die ausgestülpte Drüse kann durch Muskeln wieder eingezogen werden.[33][34][35]
Fortpflanzung
Wenn sich zwei Tiere erstmals begegnen, berühren sie sich kurz mit Fühlern und Mundwerkzeugen, wobei sie diese schnell aneinander reiben. Offensichtlich dient dies der Feststellung des Geschlechts. Gleichgeschlechtliche Tiere schnappen im Folgenden bösartig gegeneinander, verwickeln sich möglicherweise in einen kurzen Kampf und trennen sich dann schnell und weiträumig. Bei verschieden geschlechtlichen Tieren dagegen versucht das Männchen sofort, dem Weibchen aufzureiten. Häufig versucht das Weibchen dies zu verhindern, indem es schnell wegläuft oder indem es den Hinterleib hochhebt. Das Männchen lässt jedoch in der Regel erst nach längeren vergeblichen Versuchen davon ab, das Weibchen zu bedrängen.
Wenn das Weibchen es zulässt, besteigt das Männchen von hinten das Weibchen. Dann versucht es, mit der leicht gesenkten Hinterleibsspitze die etwas angehobene Hinterleibsspitze des Weibchens zu berühren, während es gleichzeitig die Geschlechtsorgane ausstülpt. Während des Einführens des Penis in den weiblichen Geschlechtstrakt ruhen die Vorderbeine des Männchens auf den Schultern des Weibchens, wobei das Klauenglied über den Flügeldeckenrand hinausragt, die restlichen Tarsenglieder breit der Flügeldecke aufliegen. Das mittlere Beinpaar stützt sich entweder auf dem Rand der Hinterleibssegmente oder auf dem Untergrund ab. Die Hinterbeine positioniert das Männchen jeweils seitlich vom Hinterleib des Weibchens auf dem Untergrund. Diese Umarmungshaltung wird jedoch nicht lange eingehalten. Während der Kopulation beginnt das Weibchen gelegentlich, sich fortzubewegen, und das Männchen versucht darauf, seine unsichere Stellung beizubehalten. Gewöhnlich jedoch verharrt das Weibchen einige Sekunden still. Wenn es dann jedoch los läuft, rutscht das Männchen ab und als Folge sind Männchen und Weibchen in nahezu entgegengesetzte Richtungen positioniert. In der Regel schleift, unabhängig vom Geschlecht, der größere Partner den schwächeren einige Zeit hinter sich her, wobei die Partner lediglich an den Geschlechtsorganen zusammenhängen. Der schwächere Partner versucht nur selten, sich dem stärkeren zu widersetzen, nämlich ihn seinerseits wegzuziehen.
Die Kopulation kann über eine Stunde dauern. Während dieser Zeit erbeuten und verspeisen die Partner häufig mehrere Fliegenlarven, bis sich die Kopula löst. Gelegentlich versucht ein zweites Männchen, sich mit einem bereits verpaarten Weibchen zu paaren. Die beiden Männchen greifen sich dann aggressiv mit den Oberkiefern an. Wenn sich dabei die Kopula löst, versucht das stärkere Männchen, sich mit dem Weibchen zu paaren. In Abwesenheit von Weibchen verhalten sich Männchen zueinander völlig desinteressiert.
In Gefangenschaft bei wenig Raum versuchen die Männchen beim geringsten Kontakt mit Weibchen zu kopulieren, auch wenn sie unmittelbar davor das gleiche Weibchen begattet haben. Die Kopula dauert dann jedoch nur drei bis fünf Minuten.[21][36]
Entwicklung
Von der Eiablage bis zum Schlüpfen der Larve vergehen etwa zwei Tage. Die Larvenstadien insgesamt bis zur Verpuppung werden im Sommer in etwa dreiundzwanzig Tagen durchlaufen. Das Puppenstadium dauert durchschnittlich zwölf Tage. Für die Entwicklung braucht die Art also durchschnittlich 37 Tage. Im Labor betrugen die durchschnittlichen Entwicklungszeiten bei 50%iger Luftfeuchtigkeit und 12-stündiger Belichtung pro Tag bei 16° 1523 Stunden (64,4 Tage), bei 24° rund 857 Stunden und bei 32° 571 Stunden (23,8 Tage).[27] Die Larven des ersten Stadiums sind sechs bis neun Millimeter lang, die des zweiten Stadiums zehn bis fünfzehn Millimeter. Im dritten und letzten Stadium wird die Larve fünfzehn bis 25 Millimeter lang und damit sogar etwas größer als das vollständig entwickelte Insekt.[37] Eine genaue Zusammenstellung der Dauer jedes Entwicklungsstadiums im Labor bei sieben verschiedene Temperaturen zwischen 15° und 30° getrennt für Ei, 1., 2., 3. Larvenstadium und Puppe, jeweils für Männchen und Weibchen getrennt, findet man bei Frątczak-Łagiewska und Matuszewski.[38]
Die Eier werden ausnahmsweise auf dem Boden, gewöhnlich jedoch ein bis fünf Zentimeter unter der Erdoberfläche einzeln abgelegt. Das Weibchen sucht nicht lange nach einer geeigneten Stelle, sondern es drückt den Hinterleib auf den Boden, worauf die Hinterleibsspitze je nach Bodenbeschaffenheit tiefer bis gar nicht in das Substrat eindringt. Dies nimmt weniger als eine Minute in Anspruch und das Weibchen prüft in keiner Weise das Ergebnis der Eiablage, sondern läuft einfach weg. Trotzdem ist diese Art der Eiablage sinnvoll, da die Tiere sich nahe von Aas paaren und der Boden dort meist durch die beim Verwesungsprozess entstehende Flüssigkeit und andere vom Aas angezogene Tiere aufgelockert ist. Die Larven verbleiben normalerweise im Boden. Vor der Verpuppung verkürzt und verdickt sich die Larve und drückt eine ovale Höhlung in den Boden. In ihr verharrt sie zwei bis drei Tage lang in gekrümmter Haltung bis zur Verpuppung.[21][36]
Im Laborversuch legten Weibchen, die mit Larven von Schmeißfliegen gefüttert wurden, mehr und länger Eier ab als Weibchen, die mit Larven der Stubenfliege gefüttert wurden. Gut ernährte Weibchen legten täglich durchschnittlich über acht Eier, schlecht ernährte nur etwas über zwei Eier pro Tag. Ein Weibchen kann bis zu etwa 500 Eier ablegen. Beim Vergleich von drei Feuchtigkeitsgraden erfolgte die Eiablage und der Erfolg beim Schlüpfen unabhängig von der Feuchtigkeit, die Larven bevorzugten jedoch ein Substrat von vier bis sechs Prozent Feuchtigkeit gegenüber einem Substrat mit nur zwei Prozent Feuchtigkeit.[39]
Verbreitung
In Europa findet man ausschließlich die Unterart C. maxillosus maxillosus. Diese ist in fast ganz Europa und darüber hinaus in der Paläarktis weit verbreitet. Die gleiche Unterart wird auch im Osten Nordamerikas und aus Südamerika (Chile, Argentinien, Peru) und von den meisten atlantischen Inseln gemeldet. Höchstwahrscheinlich handelt es sich bei diesen Vorkommen um Verschleppung durch den Menschen. Die Unterart C. maxillosus villosus dagegen zeigt eine überwiegend nearktische Verbreitung. Diese Unterart ist in Nordamerika, auf den Aleuten und Hawaii weit verbreitet, nach Süden strahlt sie nach Mexiko, Mittelamerika, und auf die Westindische Inseln aus mit Kuba, Jamaika, der Dominikanischen Republik. Betrachtet man Creophilus arctica als Synonym von C. maxillosus villosus, so ist die Unterart auch in der paläariktischen Region vertreten, nämlich auf der Halbinsel Kamtschatka.[2]
Literatur
- Heinz Freude: Die Käfer Mitteleuropas. Hrsg.: Karl Wilhelm Harde, Gustav Adolf Lohse. Band 4 Staphylinidae I. Elsevier, Spektrum, Akad. Verl., München 1964, ISBN 3-8274-0678-1. S. 192
- Edmund Reitter: Fauna Germanica, die Käfer des Deutschen Reiches, II. Band, K.G.Lutz' Verlag, Stuttgart 1909, S. 116
- Gustav Jäger (Hrsg.): C. G. Calwer’s Käferbuch. K. Thienemanns, Stuttgart 1876, 3. Auflage, S. 144 als Styphylinus maxillosus
Einzelnachweise
- Creophilus maxillosus und Creophilus maxillosus maxillosus bei Fauna Europaea, abgerufen am 6. Januar 2019.
- Dave J. Clarke: Testing the phylogenetic utility of morphological character systems, with a revision of Creophilus Leach (Coleoptera, Staphylinidae) in ZOOLOGICAL Journal of th Linnean Society Band 163, Nummer 3, November 2011, doi:10.1111/j.1096-3642.2011.00725.x.
- Carolus Linnaeus: Systema naturæ per regna tria naturæ, secundum classes, ordines, genera, species, cum characteribus, differentiis, synonymis, locis 1. Band, 10. Ausgabe, Stockholm 1758 S. 425:421 Nr. 3 maxillosus.
- Carolus Linnaeus: Fauna Svecica.... Stockholm 1746 S. 192, Nr. 603 Staphylinus ...
- J. G. Wood: Insects at home. New York 1872, S. 76 maxillosus = large-jawed.
- Der Käfersammler Illustrierte Taschenbücher für die Jugend Band 22, Hrsg: Redaktion des Guten Kameraden, bearbeitet von Alexander Bau, 8. Auflage, Stuttgart, Berlin, Leipzig 1911, deutscher Name S. 21.
- Jiří Zahradník: Illustriertes Lexikon der Käfer Dörfler Verlag © AVENTINUM s.r.o.Prag
- Thomas Moufet: Insectorum sive minimorum animalium theatrum, 1934, S. 197.
- Carolus Linnaeus: Systema naturæ sistens regna tria naturæ, in classes et ordines, genera et species redacta 9. Ausgabe, Leiden (Lugduni Batavorum) 1756, S. 64, Nr. 179 Staphylinus.
- W. E. Leach in G. Samouelle: The entomologist’s useful compendium; or an introduction to the knowledge of British insects comprising the best means of obtaining and preserving them, and a description of the apparatus generally used; together with the genera of Linné, and the modern method of arranging the classes Crustacea, Myriapoda, spiders, mites and insects from their affinities and structure, according to the views of Dr. Leach. Also an explanation of the terms used in entomology: a calendar of the times of appearance, and usual situations of near 3000 species of British insects; with instructions for collecting and fitting up objects for the microscope London 1819 (S. 172 Creophilus).
- Sigmund Schenkling: Erklärung der wissenschaftlichen Käfernamen aus Reitterʼs Fauna Germanica. K.G. Lutz, Stuttgart 1917. Gattungen und Untergattungen.
- John O. Westwood: An Introduction to modern classification of Insects. Band 1, London 1839 (Abbildung S. 160 und Abbildung abgebildetes Objekt fraglich).
- A. Kemner: Beiträge zur Kenntnis einiger schwedischen Koleopterenlarven I. In: Arkiv för Zoologi. Band 7, Nummer 31, Uppsala / Stockholm, S. 16 ff Creophilus maxillosus und S. 20 Bewertung der Zeichnung Westwoods.
- John Richardson: Fauna Boreali-Americana. Northern Zoology Part IV, Norwich 1837 (S. 95 Unterschiede).
- Albert Fauvel: Synopsis des Creophilus. In: Tijdschrif voor entomologie. 18. Teil, 'Sgravenhaage 1875 (S. 54f Schlüssel-Varianten).
- H.C. Küster: Die Käfer Europas – nach der Natur beschrieben. 26. Heft, Nürnberg 1853, nicht durchpaginiert, Staphylinus maxillosus.
- Ludwig Ganglbauer: Die Käfer Mitteleuropas. 2. Band, Wien 1895 (Creophilus maxillosus S. 415).
- W.F. Erichson: Naturgeschichte der Insecten Deutschlands 1. Abtheilung Coleoptera. 2. Band, Berlin 1856 (S. 528).
- Richard E. Blackwelder: Morphology of the coleopterous family Staphylinidae. In: Smithsonian Miscellaneous Collections. Band 94, Publikation 3343, Washington 1936 (biodiversitylibrary.org)
- Bilder von Larven: bugguide.net biodiversidadvirtual.org, biodiversidadvirtual.org.
- Cyril E. Abbott: The development and general biology of Creophilus villosus Gray. In: Journal of the New York Entomological Society. Band 46, New York 1938, S. 49–53, JSTOR 25004733 (S. 49 ff).
- Bild einer Puppe.
- Sergey Victorovich Pushkin: Necrobionts an Necrophilous Beetles (Insecta; Coleoptera) of the South of the Russia. In: World Applied Sciences Journal. Band 32, Nummer 4, 2004, S. 618–625, doi:10.5829/idosi.wasj.2014.32.04.14517, S. 6/623
- Erin J. Watson-Horzelski, Anna C. Clark-Aguilard: Predatory Behavior of Creophilus maxillosus (L.) (Coleoptera: Staphylinidae) towards the invasive Blow Fly Chrysomaya rufifacies (Macquart) (Diptera: Calliphoridae). In: The Coleopterists Bulletin. Band 65, Nummer 2, S. 177–182, doi:10.1649/072.065.0218.
- George S. Fichter: Necrophily vs. Necrophagy. In: Ohio Journal of Science. Band 49, Nummer 5, September 1949, S. 201–204, hdl:1811/3719.
- Szymon Matuszewski: Estimating the Preappearance Interval from Temperature in Creophilus maxillosus L. (Coleoptera, Staphylinidae). In: Journal of Forensic Sciences. Band 57, Nummer 1, Januar 2012, S. 136–145, doi:10.1111/j.1556-4029.2011.01958.x.
- Erin J. Watson-Horzelski: Survival and time of development for Creophilus maxillosus (L.) (Coleoptera, Staphylinidae) at three constant Temperatures. In: Coleopterists Bulletin. Band 66, Nummer 4, Dezember 2012, S. 365–370, JSTOR 41819746.
- Sz. Matuszewski, D. Bajerlein, Sz. Konwerski, K. Szpila: Insect succession and carrion decomposition in selected forests in Central Europe, Part 3: Succession of carrion fauna. In: Forensic Science International. Band 207, 15. April 2011, S. 150–163, doi:10.1016/j.forsciint.2010.09.022.
- S. Vanin, E. Zanotti, D. Gibelli, A. Taborelli, S. Andreola, C. Cattaneo: Dekomposition and entomological colonization of charred bodies - a pilot study. In: Croatian Medical Journal. Band 54, Nummer 4, August 2013, PMC 3760664 (freier Volltext).
- Szymon Matuszewski, Michał Szafałowicz: Temperature-dependent appearence of forensically useful beetles on carcasses. In: Forensic Science International. Band 229, Nummer 1–3, 10. Juni 2013, S. 92–99, doi:10.1016/j.forsciint.2013.03.034 (PDF).
- Sz. Matuszewski, K. Frątczak-Łagiewska: Size at emergence improves accuracy of age estimates in forensically-useful beetle Creophilus maxillosus L. (Staphylinidae). In: Scientific Reports, Band 8, 2018, Artikel 2390, doi:10.1038/s41598-018-20796-1.
- Thomas Eisner, Maria Eisner, Melody Siegler: Secret Weapons. Cambridge, Massachusetts / London, England 2005 (Vorschau in der Google-Buchsuche)
- M. Jefson, J. Meinwald, S. Nowicki, K. Hicks, Th. Eisner: Chemical defense of a rove beetle (Creophilus maxillosus). In: Journal of Chemical Ecology. Band 9, Nummer 1, S. 159–180, doi:10.1007/BF00987779.
- Angela Huth, Konrad Dettner: Chemische Abwehr der Grosskurzflügler aus dem Subtribus Staphylinina (Col.: Staphylinidae). In: Mitteilungen der Deutschen Gesellschaft für allgemeine und angewandte Entomologie e. V. Gießen 1989, (PDF)
- Fr. Dierckx: Les glandes pygidiennes des Staphylinides et Cicindelides. In: Zoologischer Anzeiger. Band 22, Leipzig 1899, S. 311 ff
- George S. Fichter: Notes on the mating behavior and oviposition of Creophilus maxillosus (Linné). In: Entomological News. Band 60, S. 175–178, Philadelphia Pennsylvania, 1938 (S. 175 ff).
- K. Frątczak, Sz. Matuszewski: Instar determination in forensically useful beetles Necrodes littoralis (Silphidae) and Creophilus maxillosus (Staphylinidae). In: Forensic Science International. Band 241, 2014, S. 20–26, doi:10.1016/j.forsciint.2014.04.026 (Abstract).
- Katarzyna Frątczak-Łagiewska, Szymon Matuszewski: Sex-specific developmental models for Creophilus maxillosus (L.) (Coleoptera: Staphylinidae): searching for larger accuracy of insect age estimates. In: International Journal of Legal Medicine. Band 122, Nummer, 3, Mai 2018, S. 887–885, doi:10.1007/s00414-017-1713-4.
- Gerald L. Greene: Rearing Techniques for Creophilus maxillosus (Coleoptera, Staphylinidae) a Predator of Fly Larvae in Cattle Feedlots in Oxford Acadamic, Journal of Entomology Vol 89 Issue 4 August 1996, doi:10.1093/jee/89.4.848.