cine-Substitution
Als cine-Substitution wird in der organischen Chemie ein Sonderfall von Substitutionsreaktionen an aromatischen Verbindungen bezeichnet, bei denen der neue Substituent eine benachbarte Position zur Abgangsgruppe am aromatischen Ring einnimmt.[1][2]
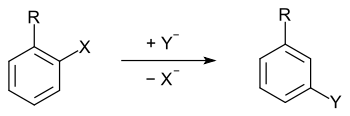
In der Regel wird bei nukleophilen Substitutionsreaktionen das Nukleophil am selben Kohlenstoffatom gebunden, an dem sich die Fluchtgruppe (Abgangsgruppe) befindet. Allgemeiner formuliert: Der Austausch der Liganden findet am selben Zentrum statt. Einige nukleophile Substitutionsreaktionen an benzoiden (aromatischen) Verbindungen (nukleophile aromatische Substitution) laufen jedoch nicht nach diesem Prinzip ab; die eintretende Gruppe kann an einer anderen Ringposition gebunden werden als die zu Beginn von der Fluchtgruppe besetzten.
Die US-amerikanischen Chemiker Joseph F. Bunnett und Roland E. Zahler schlugen für diese Fälle den Begriff „cine-Substitution“ vor, „from the Greek cine, to move“.[3] Im Altgriechischen bedeutet κινέω (kineo) unter anderem: fortbewegen, verjagen, in die Flucht schlagen. Im Deutschen sollte cine also kine gesprochen werden, analog Kinetik oder Kino (engl. cinema!).
Der Begriff cine-Substitution ist eine rein phänomenologische Beschreibung, welche die Reaktion als "single process" betrachtete. In der Realität bestehen cine-Substitutionen aber aus mehreren Teilschritten und können außerdem nach unterschiedlichen Reaktionsmechanismen ablaufen. Daher ist die Klassifizierung von Reaktionen nach diesem Begriff von beschränkter Aussagekraft.
Beispiele
Substitionen an Halogen-nitrobenzolen (Nitro-halogenbenzolen)
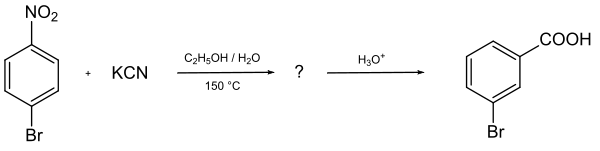
Das vermutlich älteste Beispiel dieses Reaktionstyps wurde 1871 durch V. von Richter beschrieben, der fand, dass bei der Umsetzung von 4-Bromnitrobenzol mit Kaliumcyanid in Ethanol/Wasser 3-Brombenzoesäure gebildet wurde (Von-Richter-Reaktion).
Dow-Phenolsynthese
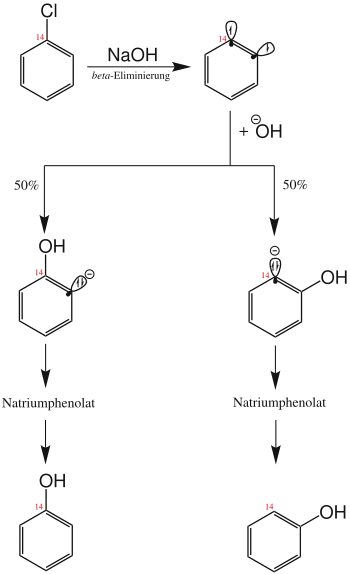
Bei der von der amerikanischen Firma Dow entwickelten Phenolsynthese erfolgt die Umsetzung von Chlorbenzol mit überhitzter, wässriger Natronlauge. Ihr kommt in der heutigen präparativen Chemie allerdings nur noch eine geringe Bedeutung zu. Die Beobachtung, dass sich die Hydroxygruppe des Produkts zu 50 % am C-1-Atom des Benzolrings befand und zu 50 % an benachbarter Stelle, lässt sich anhand des Reaktionsmechanismus (siehe Abbildung) erklären.
Chlorbenzol reagiert zunächst unter Abspaltung von Chlorwasserstoff zu Dehydrobenzol, das als stark winkelgespanntes Alkin so reaktiv ist, dass es mit der Natronlauge zu (2-Hydroxyphenyl)natrium weiterreagiert. Dieses wiederum wird zu Natriumphenolat, dem Natriumsalz der konjugierten Base des Zielmoleküls Phenol, umprotoniert. Das Endprodukt Phenol wird durch Aufarbeitung des Natriumphenolats im sauren Milieu erhalten.[4]
Substitutionen nicht-aromatischer Verbindungen
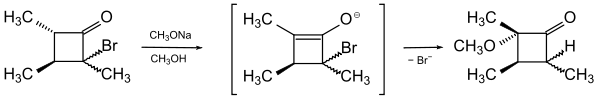
Auch für den „anormalen Reaktionsverlauf“ der Methanolyse von 2-Brom-2,3,4-trimethylcyclobutanon in Gegenwart von Natriummethoxid wurde der Begriff benutzt.[5] Hier wird im ersten Schritt ein Enol oder Enolat gebildet. Das nun in Allylstellung geratene Bromatom dissoziiert als Bromid-Ion. Die eintretende Methoxygruppe befindet sich aber in der 4-Position.
Dieses Beispiel zeigt, dass auch nukleophile Substitutionen von Allylverbindungen, z. B. nach dem SN2‘-Mechanismus, als cine-Substitutionen definiert werden könnten. Wie oben erwähnt, ist aber damit für das Verständnis der Reaktionen nichts gewonnen.
Ähnliche Begriffe
Weitere, die Position der Eingangsgruppe bei aromatischen Verbindungen beschreibende Begriffe sind ipso und tele.
Einzelnachweise
- Eintrag zu cine-substitution. In: IUPAC (Hrsg.): Compendium of Chemical Terminology. The “Gold Book”. doi:10.1351/goldbook.C01081 – Version: 2.3.2.
- Hans-Dieter Jakubke, Ruth Karcher (Hrsg.): Lexikon der Chemie, Spektrum Akademischer Verlag, Heidelberg, 2001.
- Joseph F. Bunnett und Roland E. Zahler: Aromatic Nucleophilic Substitution Reactions, Chem. Rev. 49, 273–412 (1951), S. 382–391, doi:10.1021/cr60153a002.
- Reinhard Brückner: Reaktionsmechanismen; Organische Reaktionen – Stereochemie – Moderne Synthesemethoden, 3. Auflage, Spektrum Akademischer Verlag, München (2004), Seite 254f., ISBN 9783827415790.
- J. M. Conia und M. J. Robson: Ringverengungen und Ringerweiterungen vicinal disubstituierter Cyclobutane bzw. Cyclopropylmethylverbindungen Angew. Chem., 87, 505–516 (1975). doi: 10.1002/ange.19750871404.
Literatur
- Siegfried Hauptmann: Organische Chemie. Verlag Harri Deutsch, Frankfurt a. M. 1985, 1. Auflage, S. 301–302, ISBN 3-342-00280-8.