Christoph Cremer
Christoph Cremer (* 12. Juli 1944 in Freiburg im Breisgau) ist ein deutscher Physiker und Emeritus[1] der Ruprecht-Karls-Universität Heidelberg, ehemaliger Honorarprofessor an der Johannes Gutenberg-Universität Mainz[2][3] und war früher Forschungsgruppenleiter am Institut für Molekulare Biologie in Mainz[4][5], der die konventionelle lichtoptische Auflösungsgrenze („Abbe-Limit“) durch unterschiedliche Methoden überwunden hat (1996 Lokalisationsmikroskopie SPDM; 1997 räumlich strukturierte Beleuchtung SMI). Zwischenzeitlich ist Christoph Cremer laut eigener Aussage Angehöriger des Max-Planck-Institut für Chemie und des Max-Planck-Institut für Polymerforschung.[6][7][8][9]
Leben
Christoph Cremer entstammt einer Familie mit wissenschaftlichem und sozio-theologischem Hintergrund, so war Vater Hubert Cremer Professor für Mathematik und Großrechenanlagen an der RWTH Aachen, sein Onkel Lothar Cremer gilt als einer der führenden Wissenschaftler des 20. Jahrhunderts auf dem Gebiet der Technischen Akustik und seine Tante Erika Cremer, Entwicklerin zu den Grundlagen der Adsorptionsgaschromatographie, war 1940 die erste Physikprofessorin an der Universität Innsbruck. Cremers Mutter Elisabeth Rahner beschrieb bereits in den 1930er Jahren noch heute aktuelle Formen der Zusammenarbeit von Eltern und Kinderbetreuungseinrichtungen,[10][11][12] wohingegen ihre Brüder Karl Rahner und Hugo Rahner als überaus bedeutende Theologen des vergangenen Jahrhunderts gelten.
Sein Bruder Thomas Cremer[13] ist als Medizinprofessor an der Ludwig-Maximilians-Universität München ebenfalls in der Wissenschaft tätig, während der jüngste Bruder Georg Cremer, Professor für Wirtschaftswissenschaften, Generalsekretär des deutschen Caritasverbandes war.
Nach einigen Semestern Philosophie und Geschichte an den Universitäten Freiburg und München studierte Christoph Cremer Physik (unterstützt von der Studienstiftung des deutschen Volkes) in München und promovierte in Genetik/Biophysik in Freiburg. Es folgten eine Postdoc-Zeit am Institut für Humangenetik der Universität Freiburg, ein mehrjähriger USA-Aufenthalt an der University of California und die Habilitation (Dr. med. habil. für Allgemeine Humangenetik und Experimentelle Cytogenetik, Medizinische Fakultät Universität Freiburg). Von 1983 bis zu seiner Emeritierung lehrte er als Professor (Ordinarius) für Angewandte Optik und Informationsverarbeitung an der Universität Heidelberg, am Kirchhoff-Institut für Physik. Darüber hinaus war er in seiner Eigenschaft als Arbeitsgruppenleiter am Kirchhoff-Institut für Physik wissenschaftliches Mitglied des Interdisziplinären Zentrums für Wissenschaftliches Rechnen (IWR).
Christoph Cremer war an drei Exzellenzprojekten (2007–2012) der Universität Heidelberg beteiligt sowie Partner im Biotechnologie-Cluster zur zellbasierten und molekularen Medizin, einem der fünf 2008 bewilligten deutschen BMBF Spitzen-Cluster. Als gewählter zweiter Sprecher des Senats engagierte sich Cremer in seiner aktiven Zeit an der Universität Heidelberg auch hochschulpolitisch. In seiner Funktion als ‚Adjunct’-Professor an der US-University of Maine und als wissenschaftliches Mitglied des renommierten Jackson Laboratory (Bar Harbor/Maine, USA), wo er während der Semesterferien mehrere Wochen im Jahr forschte, war er am dortigen Aufbau eines biophysikalischen Zentrums (Institute for Molecular Biophysics, IMB) beteiligt, das mit der Universität Heidelberg in einem ‚Global Network’-Vorhaben verbunden ist. Er ist verheiratet mit der Architektin und Künstlerin Letizia Mancino-Cremer, seit 1992 Vorsitzende der Goethe-Gesellschaft Heidelberg.
- Super Resolution Mikroskopie von Prof. Christoph Cremer
 Nanoskopie von Brustkrebs, 3D Zweifarben Super Resolution Mikroskopie von Her2 und Her3 & Clusteruntersuchungen
Nanoskopie von Brustkrebs, 3D Zweifarben Super Resolution Mikroskopie von Her2 und Her3 & Clusteruntersuchungen Lokalisations-Mikroskopie einzelner blinkender YFP Moleküle/ SPDMphymod
Lokalisations-Mikroskopie einzelner blinkender YFP Moleküle/ SPDMphymod Zweifarben Lokalisationsmikroskopie SPDMphymod/Super Resolution Mikroskopie mit GFP & RFP Fusionsproteinen
Zweifarben Lokalisationsmikroskopie SPDMphymod/Super Resolution Mikroskopie mit GFP & RFP Fusionsproteinen Markierungs/Sonden-freie Lokalisationsmikroskopie SPDM – zuvor unsichtbare Zellstrukturen werden detektierbar
Markierungs/Sonden-freie Lokalisationsmikroskopie SPDM – zuvor unsichtbare Zellstrukturen werden detektierbar Untersuchungen an menschl. Netzhautgewebe, erkrankt an by Makuladegeneration AMD, 100nm Auflösung mit Strukturierter Beleuchtung
Untersuchungen an menschl. Netzhautgewebe, erkrankt an by Makuladegeneration AMD, 100nm Auflösung mit Strukturierter Beleuchtung Virus Super Resolution Microscopy SPDM Cremer/Wege labs
Virus Super Resolution Microscopy SPDM Cremer/Wege labs
Grundlegende Entwicklungen
Konzeption der 4Pi-Mikroskopie
Cremer war schon früh an der Weiterentwicklung der laserbasierten Lichtmikroskopie beteiligt. Erste Ideen hierzu stammten bereits aus seiner Doktorandenzeit in den 1970er Jahren. Gemeinsam mit seinem Bruder Thomas Cremer, inzwischen Professor für Anthropologie und Humangenetik an der Ludwig-Maximilians Universität München, schlug Christoph Cremer in einer Patentschrift im Jahre 1971 die Entwicklung einer Hologramm basierten 4Pi-Laserscanning-Mikroskopie (DE Offenlegungsschrift 2116521) vor. Diese Patentschrift enthält bereits erste Ideen zur Verwendung photoschaltbarer Moleküle zu einer verbesserten lichtoptischen Gewinnung von Nanostrukturinformation.
Die Grundidee bestand darin, Laserlicht von allen Seiten (Raumwinkel 4Pi) zu einem „spot“ mit einem Durchmesser kleiner als bei der konventionellen Laserscanningmikroskopie zu fokussieren und mit diesem das Objekt punktweise abzutasten; so sollte die optische Auflösung über die konventionelle Grenze (etwa 200 nm lateral, 600 nm axial) hinaus verbessert werden.[14][15] Seit 1992 wurde die 4Pi-Mikroskopie unter Verwendung von zwei gegenüberliegenden Mikroskopobjektiven hoher Numerischer Apertur von Stefan Hell (derzeit Direktor am Max-Planck-Institut für biophysikalische Chemie, Göttingen) zu einem leistungsfähigen höchstauflösenden Abbildungsverfahren entwickelt.[16][17]
Erste DNA-Bestrahlungstechnik für lebende Zellen
Anfang der 1970er Jahre entwickelten die Brüder Christoph und Thomas Cremer eine Laser-UV-Mikrobestrahlungsapparatur, welche erstmals die gezielte Bestrahlung eines Teilbereiches lebender Zellen im Absorptionsmaximum der DNA (257 nm) ermöglichte und die 60 Jahre übliche konventionelle UV-Partialbestrahlung ablöste.[18] Es konnten so zum ersten Mal gezielt (also an vorausgewählten Stellen im Kern lebender Zellen) DNA-Läsionen verursacht werden, ohne die Teilungs- oder Lebensfähigkeit der Zelle auszuschalten. Spezifische kleine Zellbezirke konnten mikrobestrahlt und die Dynamik von dort vorhandenen Makromolekülen mengenmäßig abgeschätzt werden. Darüber hinaus erlaubte die hohe Geschwindigkeit des Verfahrens von Sekundenbruchteilen Bestrahlungsdauer die gezielte Bestrahlung von sich bewegenden Zellorganellen. Diese Entwicklung stellte die Grundlage für wichtige Experimente im Bereich der Erforschung des Erbgutes dar (Nachweis von „Chromosomenterritorien“ in lebenden Säugerzellen)[19] und führte 1979/1980 zu einer erfolgreichen Zusammenarbeit mit der Biologin Christiane Nüsslein-Volhard (heute Direktorin am Max-Planck-Institut für Entwicklungsbiologie Tübingen, Nobelpreis 1995). Christoph Cremer setzte bei dieser Kooperation seine Laser-UV-Mikrobestrahlungsapparatur ein, um zelluläre Veränderungen in frühen Larvenstadien der Taufliege zu erzeugen.[20][21]
Entwicklung der Konfokalen Laser-Scanning-Mikroskopie für Fluoreszenz
Auf der Grundlage der bei Bau und Anwendung der Laser-UV-Mikrobestrahlungsapparatur gesammelten Erfahrungen konzipierten die Cremer-Brüder 1978 ein lichtoptisches Laser-Scanning-Verfahren, bei dem die dreidimensionale Objektoberfläche von einem fokussierenden Laserstrahl punktweise abgerastert und dort spezifisch markierte Bereiche zur Fluoreszenz angeregt wurden. Das Bild wurde dann ähnlich wie beim Rasterelektronenmikroskop oder bei dem Scanning Optical Microscope von Davidovits and Egger[22] auf elektronischem Wege punktweise zusammengesetzt.[14]
Besonderer Augenmerk wurde jedoch gelegt auf a) die Bildgebung von spezifisch fluoreszenz-markierten Strukturen b) die Erhöhung des Signalkontrastes in axialer Richtung mithilfe einer in der Bildebene angebrachten kleinen Lochblende vom Durchmesser des dort von einem punktförmigen fluoreszierenden Objekt erzeugten Beugungsscheibchens; diese Grundidee der konfokalen Mikroskopie wurde bereits 1957 von Marvin Minsky zum Patent angemeldet, jedoch ohne Bezug zu Laserlichtquellen (diese waren damals noch nicht vorhanden) und ohne Berücksichtigung von Fluoreszenzanregung. Ein weiterer Unterschied zu verwandten Mikroskopiekonzepten besteht auch darin, dass aufgrund der von Cremer & Cremer gesammelten experimentellen Erfahrungen mit hochstabilen Gaslasern bei ihrem Mikroskopieverfahren auf das „Anregungspinhole“ verzichtet wurde.
Dieser Konstruktionsplan eines Konfokalen Laser Scanning Fluoreszenz Mikroskops (CSLM), mit dem erstmals die Laser-Scanning-Methode mit der dreidimensionalen (3D) Detektion fluoreszierender Objekte verbunden wurde, brachte Christoph Cremer seine Professur an der Universität Heidelberg ein. Die im folgenden Jahrzehnt insbesondere von Arbeitsgruppen an der Universität Amsterdam und am Heidelberger European Molecular Biology Laboratory (EMBL) und den damit verbundenen Industriepartnern technisch zur Anwendungsreife entwickelte Konfokale Laser Scanning Fluoreszenzmikroskopie hielt in den späteren Jahren einen breiten Einzug in die molekularbiologischen und biomedizinischen Labors und stellt noch heute den Goldstandard dar, soweit es um dreidimensionale Lichtmikroskopie mit konventioneller Auflösung geht.
Super Resolution Mikroskopie
In vielen Fällen besteht das Ziel der Mikroskopie daran, Größen einzelner kleiner Objekte zu bestimmen. In der herkömmlichen Fluoreszenzmikroskopie ist das ebenfalls nur bis zu Werten möglich, die um die konventionelle optische Auflösungsgrenze von etwa 200 nm (lateral) liegen. Die Arbeitsgruppe von Christoph Cremer hat verschiedene Super Resolution Mikroskope, wie das Vertico-SMI entwickelt, basierend auf den unterschiedlichen Technologien und jeweiligen Anforderungen. Derzeit wird eine Auflösung von 5 nm in 2D und eine bestimmbare Moleküldichte von ca. 2,8 × 104 µm−2 erreicht.
Strukturierte Beleuchtung SMI
Mitte der 1990er Jahre begann Christoph Cremer mit der Entwicklung eines lichtmikroskopischen Verfahrens, das eine wesentliche Verbesserung der Größenauflösung fluoreszenzmarkierter zellulärer Nanostrukturen gestattete. Diesmal nutzte er das Prinzip der Weitfeldmikroskopie in Verbindung mit strukturierter Laserbeleuchtung (SMI: räumlich strukturierte Beleuchtung, engl. spatially modulated illumination).[23] Gegenwärtig wird damit eine Auflösung von 30 – 40 nm (etwa 1/16 – 1/13 der verwendeten Wellenlänge) erreicht. Zusätzlich war diese Technologie nicht mehr den Geschwindigkeitsbeschränkungen der fokussierenden Mikroskopie unterworfen, so dass damit die 3D Analyse ganzer Zellen in kurzen Beobachtungszeiten (derzeit im Bereich weniger Sekunden) möglich wird.
Lokalisationsmikroskopie SPDM
Ebenfalls seit Mitte der 1990er Jahre konzipierte und realisierte Christoph Cremer fluoreszenzoptische Verfahren der Weitfeldmikroskopie, die eine Verbesserung der effektiven optischen Auflösung (im Sinne der kleinsten detektierbaren Distanz zwischen zwei lokalisierten Objekten) um ein Vielfaches der konventionellen Auflösung zum Ziel hatten (SPDM, Lokalisationsmikroskopie, engl. spectral precision distance/position determination microscopy).
SPMDphymod – Lokalisationsmikroskopie mit normalen Fluoreszenzmolekülen
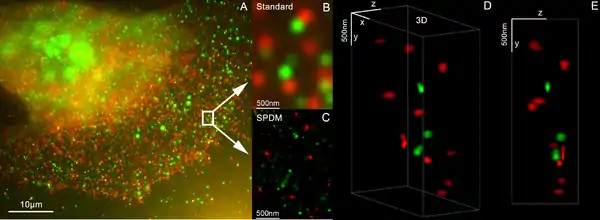
2008 fand Cremers Arbeitsgruppe heraus, dass unter bestimmten photophysikalischen Bedingungen auch viele „ganz gewöhnliche“ Farbstoffmoleküle wie GFP, RFP, YFP, Fluorescein oder Alexa-Farbstoffe und nicht nur photoschaltbare Farbstoffe für die optische Nanoskopie eingesetzt werden können. Durch die Kombination vieler tausender Einzelaufnahmen derselben Zelle wurden mithilfe von laseroptischen Präzisionsmessungen „Lokalisationsbilder“ mit wesentlich verbesserter optischer Auflösung gewonnen. Dies erweitert die Anwendbarkeit der SPDM-Methode auf zahlreiche Gebiete der biophysikalischen, zellbiologischen und medizinischen Forschung,[24] wie auch die hochauflösende Untersuchung von Viren.[25][26]
LIMON: 3D Super Resolution Mikroskopie
LIMON (Light MicrOscopical nanosizing microscopy) wurde 2001 an der Universität Heidelberg entwickelt und kombiniert die beiden Methoden Lokalisationsmikroskopie und Strukturierte Beleuchtung zur 3D Super Resolution Mikroskopie mit einer eine Auflösung von 40 nm in 3D.[27][28] Durch diese Zweifarben-Kolokalsiations 3D Super Resolution Mikroskopie wurde die räumlichen Anordnung der beiden bei Brustkrebs aktiven Gene Her2/neu und HER3 mit einer Genauigkeit von etwa 25 nm bestimmt, sowie die für die Krebsentstehung vermutlich relevante Clusterbildung auf Einzelmolekülebene analysiert.[29]
Auszeichnung
- Heidelberger Innovationsforum 2009: Schnellstes Lichtmikroskop der Welt zur besten Geschäftsidee gekürt.[30]
Schriften (Auswahl)
- Considerations on a laser-scanning-microscope with high resolution and depth of field. In: Microscopica acta. Band 81, Nr. 1, 1978, S. 31–44, PMID 713859 (uni-heidelberg.de [PDF]).
Einzelnachweise
- Fakultät für Physik und Astronomie. Abgerufen am 1. Oktober 2020.
- Honorary Professorship for IMB’s Christoph Cremer, Pressemitteilung
- Lehrende an der Fakultät für Physik, Johann-Gutenberg-Universität Mainz, abgerufen am 13. Juli 2021 https://www.iph.uni-mainz.de/lehrende/
- Optics IMB Mainz, The Cremer Lab https://www.optics.imb-mainz.de/
- 15.11.19: Perspectives of Cremer-Lab https://www.optics.imb-mainz.de/news.php
- Dr. Christoph Cremer | Max Planck Institute for Polymer Research, Germany | STEM | COP April 2021 https://www.youtube.com/watch?v=L0EMIQzyIAE
- ORCHID Connecting Research & Researches, Christoph Cremer biography https://orcid.org/0000-0002-2090-6905
- Royal Microscopy Society 2021 events https://www.rms.org.uk/rms-event-calendar/2021-events/imaging-oneworld-spatially-modulated-illumination.html
- Physics Experts, Biography Global Scientists https://biography.omicsonline.org/germany/heidelberg-university/dr-christoph-cremer-11203
- Franz Weigl, Ludwig Battista, Anton Heinen, Elisabeth Rahner, Maria Montessori: Pädagogik und Didaktik der Altersstufen. Kösel & Pustet, München 1931–1934.
- Anton Heinen, Elisabeth Rahner, Maria Montessori: Familien- und Kleinkinderpädagogik. Kösel & Pustet, 1934.
- Elisabeth Rahner: Der Gedanke der Mütterschulung in seiner Entwicklung von Comenius bis zur Gegenwart. Dissertation. 1936.
- Prof. Dr. med. Thomas Cremer. In: uni-muenchen.de. Abgerufen am 5. Juni 2018 (englisch).
- C. Cremer, T. Cremer: Considerations on a laser-scanning-microscope with high resolution and depth of field. In: Microscopica acta. Band 81, Nr. 1, 1978, S. 31–44, PMID 713859 (uni-heidelberg.de [PDF]).
- T. Cremer, C. Cremer: Rise, fall and resurrection of chromosome territories: a historical perspective. Part II. Fall and resurrection of chromosome territories during the 1950s to 1980s. Part III. Chromosome territories and the functional nuclear architecture: experiments and models from the 1990s to the present. In: European journal of histochemistry. Band 50, Nr. 4, 2006, S. 223–272, PMID 17213034 (ejh.it [PDF]).
- S. Hell, S. Lindek, C. Cremer, E. H. K. Stelzer: Measurement of the 4pi-confocal point spread function proves 75 nm axial resolution. In: Applied Physics Letters. Band 64, 1994, S. 1335–1337, doi:10.1063/1.111926.
- P. E. Hänninen, S. W. Hell, J. Salo, E. Soini, C. Cremer: Two-photon excitation 4Pi confocal microscope – Enhanced axial resolution microscope for biological research. In: Applied Physics Letters. Band 68, 1995), S. 1698–1700, doi:10.1063/1.113897 (uni-heidelberg.de [PDF]).
- C. Cremer, C. Zorn, T. Cremer: An ultraviolet Laser microbeam for 257 nm/Eine Laser-UV-Mikrobestrahlungsapparatur für 257 nm. In: Microscopica Acta. Band 75, Nr. 4, 1974, S. 331–337 (uni-heidelberg.de [PDF]).
- Christoph und Thomas Cremer sprechen über 40 Jahre gemeinsame Erforschung der funktionellen Genomarchitektur (Memento vom 25. Dezember 2015 im Internet Archive)
- M. Lohs-Schardin, C. Cremer, C. Nüsslein-Volhard: A fate map for the larval epidermis ofDrosophila melanogaster: localized cuticle defects following irradiation of the blastoderm with an ultraviolet laser microbeam. In: Developmental Biology. Band 73, Nr. 2, 1979, S. 239–255, doi:10.1016/0012-1606(79)90065-4 (uni-heidelberg.de [PDF]).
- C. Nüsslein-Volhard, M. Lohs-Schardin, K. Sander, C. Cremer: A dorso-ventral shift of embryonic primordia in a new maternal-effect mutant of Drosophila. In: Nature. Band 283, Nr. 5746, 1980, S. 474–476, doi:10.1038/283474a0 (researchgate.net [PDF]).
- Patent US3643015: Scanning optical microscope. Veröffentlicht am 19. Juni 1970, Erfinder: Paul Davidovits, Maurice David Egger.
- D. Baddeley, C. Batram, Y. Weiland, C. Cremer, U. J. Birk: Nanostructure analysis using spatially modulated illumination microscopy. In: Nature Protocols. Band 2, Nr. 10, 2007, S. 2640–2646, doi:10.1038/nprot.2007.399 (uni-heidelberg.de [PDF]).
- Manuel Gunkel, Fabian Erdel, Karsten Rippe, Paul Lemmer, Rainer Kaufmann, Christoph Hörmann, Roman Amberger and Christoph Cremer: Dual color localization microscopy of cellular nanostructures. In: Biotechnology Journal. Band 4 2009, S. 927–938, doi:10.1002/biot.200900005 (archives-ouvertes.fr [PDF]).
- C. Cremer, R. Kaufmann, M. Gunkel, F. Polanski, P. Müller, R. Dierkes, S. Degenhard, C. Wege, M. Hausmann, U. Birk: Application perspectives of localization microscopy in virology. In: Histochemistry and Cell Biology. Band 142, Nr. 1, 2014, S. 43–59, doi:10.1007/s00418-014-1203-4 (uni-heidelberg.de [PDF]).
- Qiaoyun Wang, Rüdiger Dierkes, Rainer Kaufmann, Christoph Cremer: Quantitative analysis of individual hepatocyte growth factor receptor clusters in influenza A virus infected human epithelial cells using localization microscopy. In: Biochimica et Biophysica Acta (BBA) – Biomembranes. Band 1838, Nr. 4, 2014, S. 1191–1198, doi:10.1016/j.bbamem.2013.12.014 (uni-heidelberg.de [PDF]).
- J. Reymann, D. Baddeley, P. Lemmer, W. Stadter, T. Jegou, K. Rippe, C. Cremer, U. Birk: High-precision structural analysis of subnuclear complexes in fixed and live cells via spatially modulated illumination (SMI) microscopy. In: Chromosome Research. Band 16, Nr. 3, 2008, S. 367–382, doi:10.1007/s10577-008-1238-2 (freier Volltext).
- P. Lemmer, M. Gunkel, D.Baddeley, R. Kaufmann, A. Urich, Y. Weiland, J.Reymann, P. Müller, M. Hausmann, C. Cremer: SPDM: light microscopy with single-molecule resolution at the nanoscale. In: Applied Physics B. Band 93, Nr. 1, 2008, S. 1–12, doi:10.1007/s00340-008-3152-x (freier Volltext).
- Rainer Kaufmann, Patrick Müller, Georg Hildenbrand, Michael Hausmann, Christoph Cremer: Analysis of Her2/neu membrane protein clusters in different types of breast cancer cells using localization microscopy. In: Journal of Microscopy. Band 242, Nr. 1, 2010, S. 46–54, doi:10.1111/j.1365-2818.2010.03436.x (uni-heidelberg.de [PDF]).
- Peter Saueressig: Heidelberger Innovationsforum: Schnellstes Lichtmikroskop der Welt zur besten Geschäftsidee gekürt. European Media Laboratory GmbH, Pressemitteilung vom 21. Oktober 2009 beim Informationsdienst Wissenschaft (idw-online.de), abgerufen am 5. Juni 2018.
Literatur
- Christoph Cremer, Barry R. Masters: Resolution enhancement techniques in microscopy. In: The European Physical Journal H. Band 38, Nr. 3, 2013, S. 281–344, doi:10.1140/epjh/e2012-20060-1.
- Udo Jochen Birk, Michael Hausmann: Festschrift to recognise and celebrate Christoph Cremer’s contribution to the field of biophysics on the occasion of his 65th birthday. In: European Biophysics Journal. Band 38, Nr. 6, 2009, ISSN 1432-1017, S. 719–720, doi:10.1007/s00249-009-0500-7.
Weblinks
- Literatur von und über Christoph Cremer im Katalog der Deutschen Nationalbibliothek
- Christoph Cremer's IMB Institute of Molecular Biology homepage
- "Blinkende Farbstoffe" in Ruperto Carola, Forschungszeitschrift der Universität Heidelberg
- Christoph Cremers Homepage KIP
- Pressemitteilung der Universität Heidelberg über nanoskopische Untersuchung lebender Zellverbünde mit gewöhnlichen Farbstoffen
- Pressemitteilung der Universität Heidelberg über aktuelle Entwicklungen der Lichtmikroskopie
- Pushing The Limits: Single Molecule Imaging (PDF; 160 kB)
- Verleihung der Schleiden-Medaille 2009 an Thomas Cremer für seine prägenden Arbeiten auf dem Gebiet der Zellkernarchitektur