Chapman-Umlagerung
Die Chapman-Umlagerung ist eine Namensreaktion der organischen Chemie, über die 1915 zum ersten Mal von Mumm und seinen Mitarbeitern berichtet wurde. Sie wurde in den 1920er und 1930er Jahren von A. W. Chapman intensiv erforscht.[1] Es handelt sich um eine thermische Umlagerung von Aryliminoestern zu Carbonsäureamiden:[2]
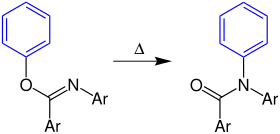
Mechanismus
Die folgende Darstellung zeigt einen plausiblen Mechanismus dieser Reaktion am Beispiel eines O-Phenyliminoesters (Ar = Arylgruppe, gleich oder verschieden).[3] Die Chapman-Umlagerung läuft sowohl in polaren als auch unpolaren Lösungsmitteln ab. In polaren Lösungsmitteln ist sie jedoch begünstigt.[1]

Erwärmt man den Aryliminoester 1, so greift das Stickstoffatom nucleophil am Phenylring an. Dieser entaromatisiert dadurch und es bildet sich ein Spirointermediat 2. Unter Rearomatisierung reagiert das Spirointemediat 2 dann zu dem Diarylamid 3.
Sie folgt annähernd einer Reaktionskinetik 1. Ordnung. Die Chapman-Umlagerung findet Anwendungen in der Herstellung von N-Arylamiden.[1]
Abnormale Chapman-Umlagerung
Falls der wandernde Arylrest in ortho-Position einen Substituenten besitzt, der in α-Position zum Arylrest ein acides H-Atom hat, kann es zu einer sogenannten „abnormalen“ Chapman-Umlagerung kommen. Dies ist beispielsweise der Fall, wenn in ortho-Position ein Methylacetatrest an die wandernde Arylgruppe (siehe 4) substituiert wurde.[1] Anhand dieses Beispiels wird der Mechanismus der „abnormalen“ Chapman-Umlagerung erklärt:

Aus der Methylacetatgruppe des Iminoesters 4 wird ein acides α-H-Atom abgespalten. Das entstandene Carbanion 5 greift intramolekular das partiell positiv geladene Kohlenstoffatom des Iminoesters 5 an. Über einen Zwischenschritt (Drehung um eine C-C-Bindung) entsteht das Phenolat 6. Bei saurer Aufarbeitung spaltet dieses Methanol ab und wird so zum Benzofuranderivat 7.
Siehe auch
Einzelnachweise
- nach: Z. Wang (Hrsg.): Comprehensive Organic Name Reactions and Reagents. John Wiley & Sons, Hoboken, New Jersey 2009, ISBN 978-0-471-70450-8, S. 627.
- Michael B. Smith: March's Advanced Organic Chemistry. 7. Auflage, Wiley & Sons, 2013, ISBN 978-0-470-46259-1, S. 1428–1429.
- nach: Z. Wang (Hrsg.): Comprehensive Organic Name Reactions and Reagents. John Wiley & Sons, Hoboken, New Jersey 2009, ISBN 978-0-471-70450-8, S. 628.
- John W. Schulenberg, S. Archer: An Abnormal Chapman Rearrangement. In: Journal of the American Chemical Society. Band 82, Nr. 8, 1960, S. 2035–2038, doi:10.1021/ja01493a046.