Brivaracetam
Brivaracetam ist ein antiepileptisch wirksamer Arzneistoff. Er wurde von der belgischen Firma UCB entwickelt und im Januar 2016 in der EU und im Februar 2016 in den USA unter dem Namen Briviact zur Zusatzbehandlung fokaler Epilepsienanfälle zugelassen bei Erwachsenen und Jugendlichen ab 16 Jahren. Fokale Anfälle sind Anfälle, die auf einer Seite des Gehirns beginnen. Bei Ausbreitung können sie größere Bereiche auf beiden Seiten des Gehirns beeinträchtigen („sekundäre Generalisierung“).
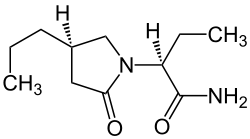
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Brivaracetam | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C11H20N2O2 | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code |
N03AX23 | |||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Wirkmechanismus |
Ligand am synaptischen Vesikelprotein 2A | |||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 212,29 g·mol−1 | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Pharmakologie
Wirkmechanismus
Brivaracetam ist ein Ligand am synaptischen Vesikelprotein 2A (SV2A).[2] Zusätzlich inhibiert es spannungsabhängige Natriumkanäle im Nervensystem. Die genaue Rolle von SV2A ist derzeit noch nicht vollständig aufgeklärt. Chemisch leitet sich Brivaracetam von Levetiracetam ab, wobei es aufgrund seiner höheren Affinität zum SV2A-Rezeptor eine stärkere antikonvulsive Wirksamkeit in Tiermodellen aufweist.
Pharmakokinetik
Brivaracetam wird fast vollständig im Gastrointestinaltrakt resorbiert und über die Niere ausgeschieden. Die Plasmahalbwertzeit beträgt 9 Stunden. Brivacetam verfügt über ein geringes Arzneimittelinteraktionspotential.
Frühe Nutzenbewertung
In Deutschland müssen seit 2011 neu zugelassene Medikamente mit neuen Wirkstoffen gemäß § 35a SGB V einer „frühen Nutzenbewertung“ durch den Gemeinsamen Bundesausschuss (G-BA) unterzogen werden, wenn der pharmazeutische Hersteller einen höheren Verkaufspreis als nur den Festbetrag erzielen möchte. Nur wenn ein Zusatznutzen besteht, kann der Arzneimittelhersteller mit dem Spitzenverband der gesetzlichen Krankenkassen einen Preis aushandeln. Die Dossierbewertungen, auf deren Basis der G-BA seine Beschlüsse fasst, erstellt das Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG).
Brivaracetam hat aufgrund einer Zulassungserweiterung zwei frühe Nutzenbewertungen durchlaufen. 2016 ging es um die Zusatzbehandlung fokaler Anfälle mit oder ohne sekundäre Generalisierung bei Erwachsenen und Jugendlichen ab 16 Jahren.[3][4] 2018 folgte eine Bewertung für Kinder und Jugendliche von 4 bis unter 16 Jahren.[5] In beiden Fällen kam der G-BA zu dem Schluss, dass ein Zusatznutzen gegenüber der jeweiligen zweckmäßigen Vergleichstherapie nicht belegt ist.[6][7]
Literatur
- P. von Rosenstiel: Brivaracetam (UCB 34714). In: Neurotherapeutics. 4, Nr. 1, Januar 2007, S. 84–87. doi:10.1016/j.nurt.2006.11.004. PMID 17199019.
- M. Bialer, SI.Johannessen, HJ.Kupferberg, RH.Levy, E.Perucca, T.Tomson: Progress report on new antiepileptic drugs: A summary of the Eight Eilat Conference (EILAT VIII). In: Epilepsy Research. 73, Nr. 1, Januar 2007, S. 5–6. doi:10.1016/j.eplepsyres.2006.10.008. PMID 17158031.
- A. Matagne, Margineanu, B.Kenda, P.Michel, H.Klitgaard: Anti-convulsiv and anti-epileptic properties of Brivaracetam (UCB34714), a high-affinity ligand for the synaptic vesicle protein, SV2A. In: British Journal of Pharmacology. 154, Nr. 8, August 2008, S. 1662–1671. doi:10.1038/bjp.2008.198. PMID 18500360.
- D.G.A. Kasteleijn-Nolst Trenité, P.Genton, D.Parain, P.Masnou, BJ.Steinhoff, T.Jacobs, E.Pigeolet: Evaluation of Brivaracetam, a novel SV2A Ligand in the photosensitivity model. In: Neurology. 69, Nr. 10, September 2007, S. 1027–1034. doi:10.1212/01.wnl.0000271385.85302.55. PMID 17785672.
- Brivaracetam, Neue Option für Erwachsene mit fokaler Epilepsie. In: Ärzte-Zeitung. Februar 2016.
- Markteinführung von „Briviact“ in Deutschland. In: Market Access & Health Policy. Februar 2016.
Weblinks
- Öffentlicher Beurteilungsbericht (EPAR) der europäischen Arzneimittelagentur (EMA) zu: Brivaracetam
Einzelnachweise
- Für diesen Stoff liegt noch keine harmonisierte Einstufung vor. Wiedergegeben ist eine von einer Selbsteinstufung durch Inverkehrbringer abgeleitete Kennzeichnung von (S)-2-((R)-2-oxo-4-propylpyrrolidin-1-yl)butanamide im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 28. Dezember 2019.
- Michael Freissmuth, Stefan Böhm, Stefan Offermanns: Pharmakologie und Toxikologie: Von den Molekularen Grundlagen zur Pharmakotherapie 2012, S. 308.
- A16-08 Brivaracetam – Nutzenbewertung gemäß § 35a SGB V. iqwig.de; abgerufen am 26. März 2020.
- A16-38 Brivaracetam – Addendum zum Auftrag A16-08. iqwig.de; abgerufen am 26. März 2020.
- A18-48 Brivaracetam (Epilepsie) – Nutzenbewertung gemäß § 35a SGB V. iqwig.de; abgerufen am 26. März 2020.
- Nutzenbewertungsverfahren zum Wirkstoff Brivaracetam (Fokale Anfälle bei Epilepsie, ≥ 16 Jahre). g-ba.de; abgerufen am 26. März 2020.
- Nutzenbewertungsverfahren zum Wirkstoff Brivaracetam (neues Anwendungsgebiet: Fokale Anfälle bei Epilepsie, Zusatztherapie, 4 bis < 16 Jahre). g-ba.de; abgerufen am 26. März 2020.