Biginelli-Reaktion
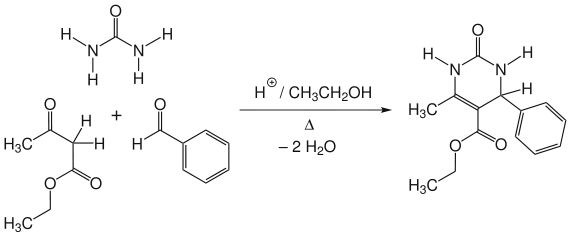
Die Biginelli-Reaktion ist eine Reaktion aus dem Bereich der Organischen Chemie und zählt zu den Mehrkomponentenreaktionen. Über die Biginelli-Reaktion berichtete der italienische Chemiker Pietro Biginelli (1860–1937) von der Universität Florenz erstmals 1893. Es ist eine säurekatalysierte Cyclokondensation von Acetessigester, Benzaldehyd und Harnstoff.[1][2] Dabei entsteht ein 3,4-Dihydropyrimidin-2(1H)-on:
Anwendung
Die Anwendungsbreite dieser Heterocyclen-Synthese ist deutlich größer. Alle drei Edukte können weit variiert werden, so dass eine große Anzahl verschiedener mehrfach funktionalisierter Pyrimidin-Derivate über die Biginelli-Reaktion zugänglich ist.[3] So kann man statt Benzaldehyd ebenso in ortho-, meta- oder para-Stellung substituierte aromatische Aldehyde einsetzen. Auch mit heteroaromatischen Aldehyden läuft die Reaktion glatt ab. Bei der Verwendung aliphatischer Aldehyde sind die Reaktionsausbeuten meist niedriger. Derivate von Aldosen können als Aldehydkomponente ebenfalls eingesetzt werden. Statt Acetessigester können viele andere CH-acide Verbindungen, wie 3-Oxocarbonsäurethioester, 1,3-Diketone etc. als Edukt in der Biginelli-Reaktion eingesetzt werden. Die Harnstoff-Komponente ist ebenso variierbar. Mit Thioharnstoff, substituierten Harnstoffen und Thioharnstoffen sowie mit Guanidinen funktioniert die Biginelli-Reaktion ebenfalls.[3]
Die Biginelli-Reaktion kann katalysiert werden durch eine Brønsted-Säure und/oder eine Lewis-Säure, wie Bortrifluorid.[4] Auch die Festphasensynthese unter Verwendung verschiedener immobilisierter Edukte ist bekannt.[5][6]
Dihydropyrimidinone, die Produkte der Biginelli-Reaktion, werden oft als Arzneistoffe eingesetzt.[7]
Mechanismus
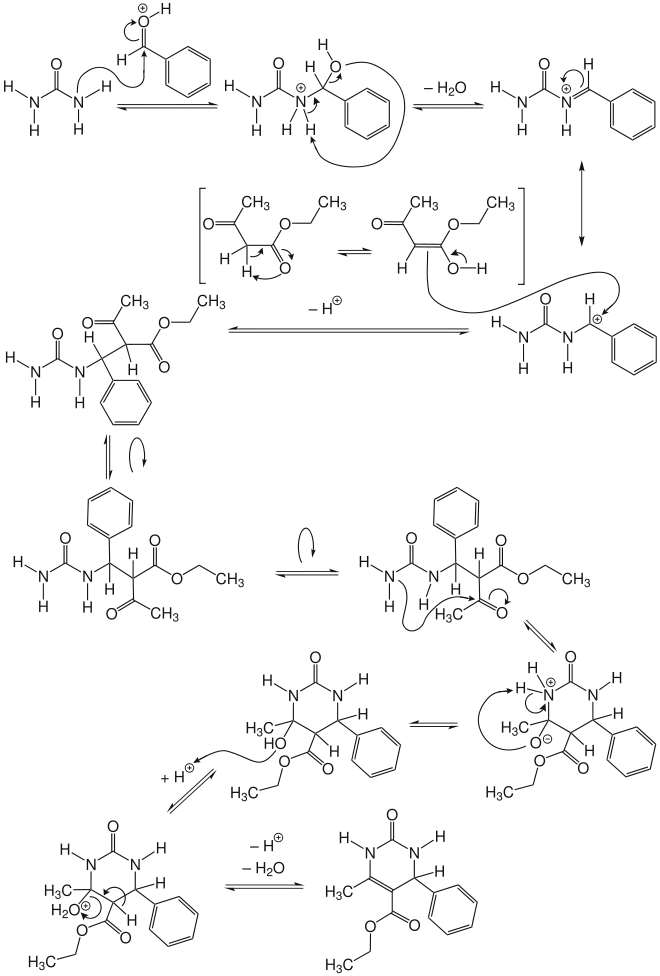
Der Reaktionsmechanismus verläuft dabei, am Beispiel der in der Einleitung genannten Edukte, nach dem folgenden Schema:[8]
Einzelnachweise
- P. Biginelli: Aldehyde-urea derivatives of aceto-and oxaloacetic acids. In: Gazz. Chim. Ital. 23, Nr. 1, 1893, S. 360–413.
- P. Biginelli: Ueber Aldehyduramide des Acetessigäthers. In: Berichte der deutschen chemischen Gesellschaft. 24, Nr. 1, 1891, S. 1317–1319, doi:10.1002/cber.189102401228.
- C. Oliver Kampe: The Biginelli Reaction. In: Jieping Zhu, Hugues Bienaymé (Hrsg.): Multicomponent Reactions. Wiley-VCH, Weinheim 2005, ISBN 978-3-527-30806-4.
- Essa H. Hu, Daniel R. Sidler, Ulf-H. Dolling: Unprecedented Catalytic Three Component One-Pot Condensation Reaction: An Efficient Synthesis of 5-Alkoxycarbonyl- 4-aryl-3,4-dihydropyrimidin-2(1H)-ones. In: The Journal of Organic Chemistry. 63, Nr. 10, 1998, S. 3454–3457, doi:10.1021/jo970846u.
- Peter Wipf, April Cunningham: A solid phase protocol of the biginelli dihydropyrimidine synthesis suitable for combinatorial chemistry. In: Tetrahedron Letters. 36, Nr. 43, 1995, S. 7819–7822, doi:10.1016/0040-4039(95)01660-A.
- C. Oliver Kappe: Highly versatile solid phase synthesis of biofunctional 4-aryl-3,4-dihydropyrimidines using resin-bound isothiourea building blocks and multidirectional resin cleavage. In: Bioorganic & Medicinal Chemistry Letters. 10, Nr. 1, 2000, S. 49–51, doi:10.1016/S0960-894X(99)00572-7.
- George C. Rovnyak, Karnail S. Atwal, Anders Hedberg, S. David Kimball, Suzanne Moreland, Jack Z. Gougoutas, Brian C. O’Reilly, Joseph Schwartz, Mary F. Malley: Dihydropyrimidine calcium channel blockers. 4. Basic 3-substituted-4-aryl-1,4-dihydropyrimidine-5-carboxylic acid esters. Potent antihypertensive agents. In: Journal of Medicinal Chemistry. 35, Nr. 17, 1992, S. 3254–3263, doi:10.1021/jm00095a023.
- László Kürti, Barbara Czakó: Strategic Applications of Named Reactions in Organic Synthesis. Elsevier Academic Press, Burlington/San Diego/London 2005, ISBN 0-12-369483-3.