Arginase 1
Arginase 1 (auch: Leber-Arginase, ARG1) ist das Enzym, das den letzten Reaktionsschritt im Harnstoffzyklus der Wirbeltiere katalysiert. Die Arginasen sind eine Gruppe von Isozymen, die in allen Lebewesen vorkommen und den Abbau der Aminosäure Arginin zu Ornithin und Harnstoff bewerkstelligen. Beim Menschen können Mutationen im ARG1-Gen zu Arginasemangel, und dieser zu einem Harnstoffzyklusdefekt mit Hyperammonämie führen. Varianten von Arginase waren in Asthmapatienten mit Nebenwirkungen auf Beta-2-Sympathomimetika assoziiert. Eine andere Variante zeigte einen Zusammenhang mit dem Myokardinfarkt-Risiko.[1][2][3][4]
| Arginase-1 | ||
|---|---|---|
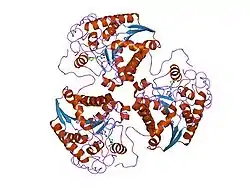 | ||
| Bändermodell der Ratten-Arginase 1 komplexiert mit Hydroxyarginin, nach PDB 1HQF | ||
|
Vorhandene Strukturdaten: s. UniProt | ||
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 322 Aminosäuren | |
| Sekundär- bis Quartärstruktur | Homotrimer | |
| Kofaktor | 2 Mn2+ | |
| Isoformen | 3 | |
| Bezeichner | ||
| Gen-Name | ARG1 | |
| Externe IDs | ||
| Enzymklassifikation | ||
| EC, Kategorie | 3.5.3.1, Hydrolase | |
| Reaktionsart | Hydrolyse einer C-N-Bindung | |
| Substrat | Arginin + H2O | |
| Produkte | Ornithin + Harnstoff | |
| Vorkommen | ||
| Homologie-Familie | Leber-Arginase | |
| Übergeordnetes Taxon | Wirbeltiere | |
| Orthologe | ||
| Mensch | Hausmaus | |
| Entrez | 383 | 11846 |
| Ensembl | ENSG00000118520 | ENSMUSG00000019987 |
| UniProt | P05089 | Q61176 |
| Refseq (mRNA) | NM_000045 | NM_007482 |
| Refseq (Protein) | NP_000036 | NP_031508 |
| Genlocus | Chr 6: 131.57 – 131.58 Mb | Chr 10: 24.92 – 24.93 Mb |
| PubMed-Suche | 383 | 11846 |
Neutrophile Granulozyten modulieren die Immunantwort durch Sekretion von Arginase. In Psoriasisläsionen wird Arginase überexprimiert. Dies führt zu verminderter Verfügbarkeit von Stickstoffoxid im Gewebe, da Arginase mit NO-Synthase um Arginin konkurriert. Dieselbe Konkurrenz innerhalb von Macrophagen wird von intrazellulären Pathogenen wie Mycobacterium tuberculosis, Toxoplasma gondii und anderen ausgenutzt, um der Immunreaktion zu entgehen.[5][6][7]
Die cAMP-abhängige Regulation der ARG1-Expression wird von Proteinkinase AI moduliert und ist auf Histon-Deacetylierung angewiesen.[8]
Katalysierte Reaktion
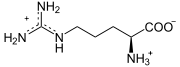 + H2O ⇔
+ H2O ⇔ ![]() +
+ 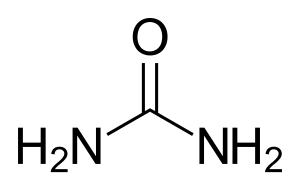
Arginin wird zu Ornithin und Harnstoff hydrolysiert.
Weblinks
- reactome: arginine → ornithine + urea
Einzelnachweise
- UniProt P05089
- Litonjua AA, Lasky-Su J, Schneiter K, et al.: ARG1 is a novel bronchodilator response gene: screening and replication in four asthma cohorts. In: Am. J. Respir. Crit. Care Med.. 178, Nr. 7, Oktober 2008, S. 688–94. doi:10.1164/rccm.200709-1363OC. PMID 18617639.
- Dumont J, Zureik M, Cottel D, et al.: Association of arginase 1 gene polymorphisms with the risk of myocardial infarction and common carotid intima media thickness. In: J. Med. Genet.. 44, Nr. 8, August 2007, S. 526–31. doi:10.1136/jmg.2006.047449. PMID 17369504.
- Harpster MH, Bandyopadhyay S, Thomas DP, et al.: Earliest changes in the left ventricular transcriptome postmyocardial infarction. In: Mamm. Genome. 17, Nr. 7, Juli 2006, S. 701–15. doi:10.1007/s00335-005-0120-1. PMID 16845475.
- Jacobsen LC, Theilgaard-Mönch K, Christensen EI, Borregaard N: Arginase 1 is expressed in myelocytes/metamyelocytes and localized in gelatinase granules of human neutrophils. In: Blood. 109, Nr. 7, April 2007, S. 3084–7. doi:10.1182/blood-2006-06-032599. PMID 17119118.
- Bruch-Gerharz D, Schnorr O, Suschek C, et al.: Arginase 1 overexpression in psoriasis: limitation of inducible nitric oxide synthase activity as a molecular mechanism for keratinocyte hyperproliferation. In: Am. J. Pathol.. 162, Nr. 1, Januar 2003, S. 203–11. PMID 12507903. PMC 1851107 (freier Volltext).
- El Kasmi KC, Qualls JE, Pesce JT, et al.: Toll-like receptor-induced arginase 1 in macrophages thwarts effective immunity against intracellular pathogens. In: Nat. Immunol.. 9, Nr. 12, Dezember 2008, S. 1399–406. doi:10.1038/ni.1671. PMID 18978793.
- Haffner I, Teupser D, Holdt LM, Ernst J, Burkhardt R, Thiery J: Regulation of arginase-1 expression in macrophages by a protein kinase A type I and histone deacetylase dependent pathway. In: J. Cell. Biochem.. 103, Nr. 2, Februar 2008, S. 520–7. doi:10.1002/jcb.21422. PMID 17577214.