Androstanol
Androstanol ist eine Verbindung aus der Stoffklasse der steroidalen Sexualhormone des Mannes, den Androgenen.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
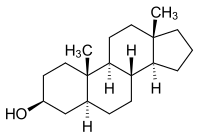 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Androstanol | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C19H32O | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 276,46 g·mol−1 | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Gewinnung und Darstellung
Androstanol wurde zunächst aus Eberhoden gewonnen. Nach folgender Vorschrift lässt es sich synthetisch darstellen:
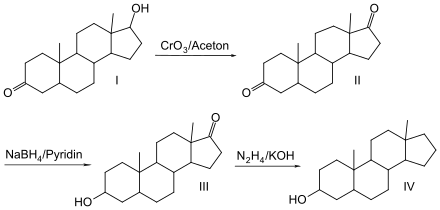
Androstan-17β-ol-3-on (I) wird mit Chrom(VI)-oxid oxidiert zum Androstan-3,17-dion (II), das wiederum mit Natriumborhydrid zum Androstan-3-ol-17β-on (III) reduziert wird, das in einer Wolff-Kishner-Reduktion mit alkalischer Hydrazinlösung umgesetzt wird zum Androstan-3-ol (IV).[3] Man erhält bei der Synthese ein Racemat aus Androstan-3α-ol[4] und Androstan-3β-ol.
Biologische Bedeutung
Androstanol ist ein Pheromon der Säugetiere.[5] Als Antagonist des konstitutiven Androstanrezeptors (constitutive androstane receptor, CAR) ist Androstanol von Bedeutung im Metabolismus von körperfremden Stoffen,[6] sogenannten Xenobiotika, aber auch von endogenen Substanzen.[7]
Literatur
- T. K. Kwan, D. J. Trafford, H. L. Makin, A. I. Mallet, D. B. Gower: GC-MS studies of 16-androstenes and other C19 steroids in human semen. In: The Journal of Steroid Biochemistry and Molecular Biology. 43(6), 1992, S. 549–556, doi:10.1016/0960-0760(92)90243-C.
- R. M. Kaminski, H. Marini, P. I. Ortinski, S. Vicini, M. A. Rogawski: The pheromone androstenol (5 alpha-androst-16-en-3 alpha-ol) is a neurosteroid positive modulator of GABAA receptors. In: Journal of Pharmacology and Experimental Therapeutics. 317(2), 2006, S. 694–703, doi:10.1124/jpet.105.098319.
- A. Nixon, A. I. Mallet, D. B. Gower: Simultaneous quantification of five odorous steroids (16-androstenes) in the axillary hair of men. In: Journal of Steroid Biochemistry. 29(5), 1988, S. 505–510, doi:10.1016/0022-4731(88)90185-9.
- Robic, Faraut, Prunier: Pathways and genes involved in steroid hormone metabolism in male pigs: a review and update. In: The Journal of Steroid Biochemistry and Molecular Biology. 140, 2014, S. 44–55, doi:10.1016/j.jsbmb.2013.11.001.
- Melanie Gimpel: GC/C-IRMS in komplexer biologischer Matrix: Untersuchungen zu den Einflussfaktoren auf die Genauigkeit der gemessenen Isotopenverhältnisse am Beispiel der Steroid-Analytik. Dissertation. TU Berlin 2010, ISBN 978-3-938163-74-0.
Einzelnachweise
- Santa Cruz Biotechnologie https://www.scbt.com/scbt/de/product/5alpha-androstan-3beta-ol-1224-92-6
- Datenblatt Androstane-3β-diol bei Sigma-Aldrich, abgerufen am 26. Juni 2017 (PDF).
- E. Elisberg, H. Vanderhaeghe, T. F. Gallagher: Preparation of 3α-Hydroxyetiocholane-17-one by a Differential Reduction from Sodium Borhydride. In: J. Am Chem Soc. 74, 1952, S. 2814–2816. doi:10.1021/ja01131a033.
- Externe Identifikatoren von bzw. Datenbank-Links zu 5α-Androstan-3α-ol: CAS-Nummer: 7657-50-3, PubChem: 449196, ChemSpider: 395796, Wikidata: Q27074463.
- George P. Rédei: Encyclopedia of Genetics, Genomics, Proteomics, and Informatics. 3. Ausgabe. Springer, 2008, S. 93.
- Wen Xie: Nuclear Receptors in Drug Metabolism. John Wiley & Sons, 2008, ISBN 978-0-470-40905-3, S. 147 und 170.
- Y. Yamamoto u. a.: The role of the nuclear receptor CAR as a coordinate regulator of hepatic gene expression. In: Biophys. 409, 2003, S. 207–211. PMID 12464260
