Ammonium-6-molybdoniccolat(II)
Bei Ammonium-6-molybdoniccolat(II) handelt es sich um eine Polyoxometallat-Spezies des Molybdän.
| Kristallstruktur | |||||||
|---|---|---|---|---|---|---|---|
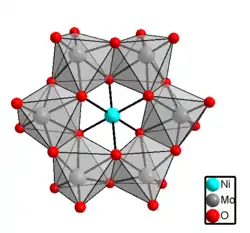 | |||||||
| Hexamolybdoniccolat-Ion in Ammonium-6-molybdoniccolat | |||||||
| Allgemeines | |||||||
| Name | Ammonium-6-molybdoniccolat(II) | ||||||
| Andere Namen |
Ammoniumhexa-μ3-hydroxynickelathexa-μ-oxododecaoxohexamolybdat(4-) | ||||||
| Verhältnisformel | (NH4)4H6NiMo6O24 | ||||||
| Kurzbeschreibung |
hellblauer kristalliner Feststoff[1] | ||||||
| Externe Identifikatoren/Datenbanken | |||||||
| |||||||
| Eigenschaften | |||||||
| Molare Masse | 1096,59 g·mol−1 | ||||||
| Aggregatzustand |
fest[1] | ||||||
| Löslichkeit |
mäßig löslich in kaltem, etwas besser in heißem Wasser[1] | ||||||
| Sicherheitshinweise | |||||||
| |||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||
Darstellung
Zur Darstellung von Ammonium-6-molybdoniccolat(II) wird in siedendem Wasser Ammoniumheptamolybdat-Tetrahydrat mit Nickelsulfat umgesetzt. Anschließend wird Ammoniumchlorid hinzugefügt.[3]
Eigenschaften
Bei Ammonium-6-molybdoniccolat(II) handelt es sich um ein Heteropolymolybdat, welches hellblaue Kristalle bildet.[1] Es kristallisiert in der Raumgruppe P21/a (Raumgruppen-Nr. 14, Stellung 3) mit den Gitterparametern a = 11,99 Å, b = 11,13 Å, c = 11,38 Å und β = 109,3°.[4]
Einzelnachweise
- Georg Brauer (Hrsg.) u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band III, Ferdinand Enke, Stuttgart 1981, ISBN 3-432-87823-0, S. 1787.
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- Kurz, Philipp; Stock, Norbert: Synthetische Anorganische Chemie: Grundkurs. Berlin: Walter de Gruyter, 2013. ISBN 978-3-11-025875-2, S. 78.
- U. Lee, H.-C. Joo, J.S. Kwon: Tetraammonium hexahydrogen hexamolybdonickelate(II) tetrahydrate, (NH4)4[H6NiMo6O24]·4 H2O. In: Acta Crystallographica, E58, 2002, S. i6–i8, doi:10.1107/S1600536801021109.
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. The authors of the article are listed here. Additional terms may apply for the media files, click on images to show image meta data.