Aluminiumcitrat
Aluminiumcitrat ist eine chemische Verbindung, die das Aluminiumsalz der Citronensäure darstellt.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
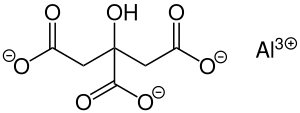 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Aluminiumcitrat | |||||||||||||||
| Andere Namen |
Aluminium-hydroxy-1,2,3-propantricarbonsäure[1] | |||||||||||||||
| Summenformel | C6H5AlO7 | |||||||||||||||
| Kurzbeschreibung |
farbloser Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 216,08 g·mol−1 (wasserfrei) | |||||||||||||||
| Aggregatzustand |
fest[1] | |||||||||||||||
| Dichte |
1,5 g·cm−3[2] | |||||||||||||||
| Löslichkeit |
langsam löslich in kaltem Wasser[3] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Darstellung
Das Dimer der Verbindung entsteht bei Zugabe von Citronensäure zu einer heißen Lösung von Aluminiumhydroxid.[5]
Verwendung
Aluminiumcitrat kann als Vernetzer für viele Polymere in der Ölindustrie verwendet werden.[6][7] Es wird auch als Antitranspirant eingesetzt.[8]
Sicherheitshinweise
In einer Studie aus dem Jahr 1996 wurde gezeigt, dass bei Verabreichung von Aluminiumcitrat 50-mal so viel Aluminium in den Körper gelangt wie bei Aluminiumhydroxid.[9]
Einzelnachweise
- Guidechem, zuletzt abgerufen am 7. Oktober 2014.
- cir-safety.org: On the Safety Assessment of Citric Acid, Inorganic Citrate Salts, and Alkyl Citrate Esters as Used in Cosmetics Cosmetic Ingredient Review, 27. März 2012, abgerufen am 23. Januar 2015.
- Dale L. Perry: Handbook of Inorganic Compounds, Second Edition. CRC Press, 2011, ISBN 978-1-4398-1462-8, S. 5 (eingeschränkte Vorschau in der Google-Buchsuche).
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- Jane E. Macintyre: Dictionary of Inorganic Compounds, Supplement 4. CRC Press, 1996, ISBN 0-412-75020-1, S. 26 (eingeschränkte Vorschau in der Google-Buchsuche).
- Johannes Fink: Oil Field Chemicals. Gulf Professional Publishing, 2003, ISBN 0-08-049757-8, S. 116 (eingeschränkte Vorschau in der Google-Buchsuche).
- G.A. Stahl, D.N. Schulz: Water-Soluble Polymers for Petroleum Recovery. Springer Science & Business Media, 1988, ISBN 0-306-42915-2, S. 303 (eingeschränkte Vorschau in der Google-Buchsuche).
- Marina Bährle-Rapp: Springer Lexikon Kosmetik und Körperpflege - Marina Bährle-Rapp. Springer-Verlag, 2012, ISBN 978-3-642-24688-3, S. 27 (eingeschränkte Vorschau in der Google-Buchsuche).
- N. D. Priest, R. J. Talbot, J. G. Austin, J. P. Day, S. J. King, K. Fifield, R. G. Cresswell: The bioavailability of 26Al-labelled aluminium citrate and aluminium hydroxide in volunteers. In: BioMetals. Band 9, Nr. 3, Juli 1996, S. 221–228, doi:10.1007/BF00817919.
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. The authors of the article are listed here. Additional terms may apply for the media files, click on images to show image meta data.