Allylumlagerung
Die Allylumlagerung beschreibt in der organischen Chemie die Umlagerung einer Doppelbindung, um mesomeriestabilisierte Allyl-Teilchen zu bilden.[1]
| Mesomere Grenzstrukturen |
|---|
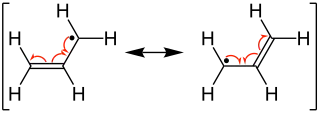 Allylradikal |
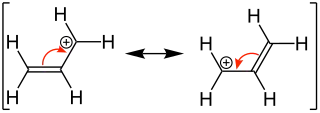 Allylcarbeniumion |
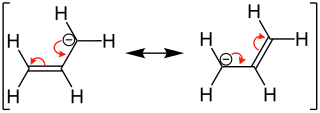 Allylanion |
Befindet sich ein Substituent an einem Kohlenstoffatom, welches in Allylstellung vorliegt, liegt ein besonders reaktives Teilchen vor. Durch die hohe Reaktivität lassen sich
- Allyl-Radikale
- Allyl-Carbeniumionen
- und Allyl-Carbanionen
in direkter Nachbarschaft zum -System einer Doppelbindung gut bilden.[1] Der Grund liegt in der Elektronendelokalisierung dieser gebildeten Teilchen, so dass sich zwei äquivalente mesomere Grenzformeln beschreiben lassen. Teilchen, von denen sich mehrere Grenzformeln zeichnen lassen, gelten als besonders stabil und lassen sich gut bilden.[1][2]
Energetische Betrachtung
Die Stabilisierung des Allyl-Systems kann auch mit Molekülorbitalen beschrieben werden. Wird z. B. das 2-Propenyl-System betrachtet, ist jeder der drei Kohlenstoffatome sp2-hybridisiert und trägt ein p-Orbital senkrecht zur Molekülebene. Die drei p-Orbitale lassen sich so kombinieren, dass drei -Orbitale entstehen. Von den drei neuen Molekülorbitalen ist eines bindend und besitzt keine Knotenebene (1), eines ist nicht bindend und hat eine Knotenebene (2) und eines ist mit zwei Knotenebenen antibindend (3). Das nicht bindende Orbital liegt dabei energetisch auf der Ebene eines nicht wechselwirkenden p-Orbitals.[1][2] Die Orbitale lassen sich mit der entsprechenden Anzahl an Elektronen füllen, wobei das Allyl-Carbeniumion mit zwei -Elektronen nur ein besetztes Orbital hat und das Allyl-Radikal und Allyl–Carbanion ein weiteres Orbital mit einem bzw. zwei Elektronen besetzt. In allen Fällen ist die Gesamtenergie niedriger als die von drei nicht wechselwirkenden p-Orbitalen, wodurch die große Stabilität der Teilchen erklärt wird.[1]

Beispielreaktionen
Radikale Substitution
Allyl-Verbindungen können in einer radikalen Substitutionsreaktion reagieren, wobei die Allylverschiebung die Produktvielfalt erklärt. Im Beispiel von Propen lässt sich eine geringe C-H-Bindungsstärke (364 kJ/mol) messen. Diese primäre C-H-Bindung ist somit sogar schwächer als eine tertiäre C-H-Bindung, so dass das Allyl-Radikal besonders stabilisiert ist und sich gut mit Hilfe von Lichtenergie bilden lässt.[1] Sobald weitere Radikale, zum Beispiel Brom-Radikale, vorliegen können zwei isomere Produkte gebildet werden.[3]
Säure-Base-Reaktion
Allyl-Carbanionen werden meist durch Entfernung eines Atoms oder einer anderen Abgangsgruppe gebildet. Besonders beliebt ist die Abspaltung eines Protons mit starken Basen wie NaNH2 oder C4H9Li.[3]
Z. B. Propen ist mit einer Acidität von pKa = 40 acider als Propan (pKa = 50). Die Bildung des Allyl-Anions ist somit begünstigt, wodurch sich das Wasserstoffatom abspalten lässt.[1]
Nukleophile Substitution
Allylverbindungen gehen sehr leicht nucleophile Substitutionsreaktionen ein, wobei die ausgeprägte Umlagerungstendenz deutlich wird.[4] Bei dem Beispiel 3-Chlorpropen befindet sich ein Chloratom an einem Kohlenstoffatom, welches in Allylstellung vorliegt. Im Unterschied zu gesättigten primären Halogenalkanen dissoziiert 3-Chlorpropen unter SN1-Bedingungen relativ schnell und geht eine schnelle Substitution über ein kationisches Intermediat ein. Das aus dem 3-Chlorpropen gebildete Carbeniumion scheint somit stabiler zu sein als andere primäre Carbeniumionen, die sich nicht so leicht bilden lassen. Bei genauen Messungen entspricht die Stabilität dem eines sekundären Carbeniumions.[1]
Die bei der Umsetzung von Allylhalogeniden mit Nucleophilen, wie zum Beispiel Bromidionen, häufig beobachtete Verschiebung der Doppelbindung beruht auf der intermediären Bildung eines mesomeriestabilisierten Carbeniumions, das über zwei potentielle Bindungsstellen für den eintretenden Substituenten verfügt. Insgesamt lassen sich zwei isomere Verbindungen bilden.[4]
Einzelnachweise
- K. Peter C. Vollhardt, Neil E. Schore: Organische Chemie. Hrsg.: Holger Butenschön. 4. Auflage. Wiley-VCH, Weinheim 2007, ISBN 3-527-31380-X, S. 682–685.
- Jonathan Clayden, Nick Greeves, Stuart Warren: Organische Chemie. 2. Auflage. Springer, Berlin 2013, ISBN 978-3-642-34715-3, S. 167–169.
- Hans Peter Latscha, Uli Kazmaier, Helmut Alfons Klein: Organische Chemie. 6. Auflage. Springer Spektrum, Heidelberg 2013, ISBN 978-3-642-36592-8, S. 331.
- Wolfgang Uhl, Apostolos Kyriatsoulis: Namen- und Schlagwortreaktionen in der organischen Chemie. Vieweg, Braunschweig 1984, ISBN 978-3-528-03581-5, S. 191–192.