Allostatische Last
Als allostatische Last werden Überbeanspruchungs- und Abnutzungseffekte bezeichnet, die in einem Organismus nach wiederholter oder chronischer Exposition gegenüber Stress auftreten. Der Begriff wurde im Jahre 1993 von McEwen und Stellar geprägt. Er bildet die physiologischen Konsequenzen einer chronischen Exposition gegenüber einer fluktuierenden oder zunehmenden neurogenen oder neuroendokrinen Kampf-oder-Flucht-Reaktion ab.
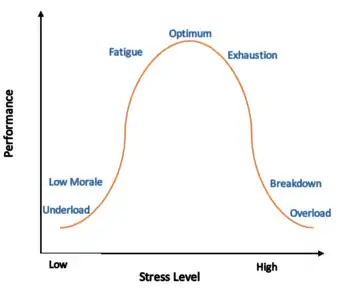
Regulationsmodell
Der Begriff der allostatischen Last drückt sog. "wear and tear"-Reaktionen aus, die als Folge einer chronischen oder wiederholten Stressexposition auftreten[1]. Er wurde erstmals im Jahre 1993 von McEwen und Stellar geprägt[2].
Die Theorie leitet sich vom Regulationsmodell der Allostase ab, welches eine prädiktive Regulation oder Stabilisierung interner Prozesse und Sensationen in Abhängigkeit von Stimuli, meist reguliert durch das Gehirn, beschreibt[3]. Es handelt sich dabei um eine Generalisierung des Konzepts der Homöostase[4][5]. "Prädiktive Regulation" steht hier für die Fähigkeit des ZNS, Bedarfssituationen vorauszusehen und darauf zu reagieren, bevor sie entstehen.[3]
Einen wesentlichen Aspekt einer effizienten Regulation stellt die Reduktion von Unsicherheit (und damit der Entropie im Sinne der Nachrichtentheorie) dar. Aufgrund von Ungewissheit, die durch das Gefühl der unvermeidbaren Überraschung eintritt, sucht der Organismus beständig nach Wegen, die Unsicherheit künftiger Entwicklungen zu vermindern. Allostatische Mechanismen helfen dabei durch die Voraussage des Bedarfs und durch eine vorausschauende Kompensation[6]. Allerdings führt diese prädiktive Regulation zu einem erheblichen Energieverbrauch, so dass die Situation, insbesondere wenn die Unsicherheit nicht behoben werden kann, in einer chronischen Akkumulation allostatischer Last enden kann.[6]
Das Konzept der allostatischen Last postuliert, dass neuroendokrine, kardiovaskuläre, neuroenergetische und emotionale Antworten konstant aktiviert bleiben, so dass Turbulenzen des Blutflusses in den Koronarien und in den hirnversorgenden Arterien, ein hoher Blutdruck, Atherogenese, kognitive Dysfunktionen und Depression den Fortschritt der Erkrankung beschleunigen.[6] Eine allostatische Last kann u. a. auf diesem Wege zu einer dauerhaft veränderten Hirnarchitektur und weiteren systemischen pathophysiologischen Effekten führen.[6]
Letztlich kann die allostatische Last die Möglichkeiten des Organismus, künftige Unsicherheit zu bewältigen, sogar vermindern.[6]
Typen der allostatischen Last
McEwen und Wingfield haben zwei Typen der allostatischen Last vorgeschlagen, die unterschiedliche Ursachen und Konsequenzen haben:
Eine allostatische Last vom Typen 1 geht aus einer adaptiven Reaktion hervor, wenn der Energieverbrauch die verfügbare Energie übersteigt. Dies führt zu einer Notreaktion ("emergency life history stage"). Diese gewährleistet das Überleben, führt zu einer positiven Energiebilanz und reduziert in der Folge wieder die allostatische Last. Typische Situationen, die zu einer allostatischen Reaktion vom Typen 1 führen sind Hungerzustände, Winterschlaf und kritische Erkrankungen. Schwere Allgemeinerkrankungen können sowohl Ursache als auch Folge der allostatischen (Über-)Last sein[7][8][9].
Eine allostatische Last vom Typen 2 tritt auf, wenn die Energiezufuhr zwar hinreichend ist, aber von sozialen Konflikten oder anderen Formen der sozialen Dysfunktion vergesellschaftet ist (also der erwartete Energieverbrauch hoch ist). Dies kann sowohl in der menschlichen Gesellschaft als auch bei Tieren, z. B. in Gefangenschaft, der Fall sein. In allen Fällen fluten die Sekretion von Glukokortikoiden und andere Allostase-Mediatoren wie die Aktivität des autonomen Nervensystems mit der allostatischen Last an und ab. Krankheiten resultieren aus chronisch erhöhter allostatischer Last oder aus allostatischer Überlast[10].
Während beide Typen der allostatischen Last mit einer gesteigerten Sekretion von Cortisol und Katecholaminen einhergehen, reagiert die Schilddrüsenhomöostase unterschiedlich: Die Konzentration des Schilddrüsenhormons T3 ist bei einer Typ-1-Allostase reduziert (Low-T3-syndrome), aber erhöht bei Typ-2-Allostase (High-T3-syndrome),[9] was durch eine Wechselwirkung der allostatischen Last mit dem Sollwert der Schilddrüsenfunktion bedingt sein könnte[11].
Messung
Üblicherweise wird die allostatische Last durch Indexvariablen im Sinne von Summen-Scores, in die Indikatoren für kumulativen Stress in verschiedenen Organen und Geweben sowie primäre Biomarker für neuroendokrine, kardiovaskuläre, immunologische und metabolische Organsysteme eingehen, ermittelt[12].
Die verwendeten Indizes sind dabei heterogen, so dass verschiedene Studien meist verschiedene Verfahren auf der Grundlage unterschiedlicher Biomarker und Berechnungsverfahren einsetzen. Andererseits ist die allostatische Last nicht spezifisch für Menschen, sondern kann beispielsweise auch für die Evaluation chronischer Stresseffekte bei nichtmenschlichen Primaten eingesetzt werden.[12]
Im endokrinen System führen hohe Stressniveaus zur vermehrten Ausschüttung des Corticotropin-Releasing-Faktors oder Corticotropin-Releasing-Hormons (CRH), das den Sollwert der HPA-Achse, des zentralen Stressantwortsystems, erhöht.[5] Andauernder Stress kann zu verminderten Cortisolkonzentrationen am Morgen und erhöhten Konzentrationen nachmittags und abends führen, was u. a. mit einer insgesamt erhöhten Cortisolausschüttung und konsekutiv erhöhten Blutzuckerwerten sowie verminderter Knochendichte einhergeht.
Im Nervensystem kann chronischer Stress zu strukturellen und funktionellen Veränderungen und Abnormalitäten führen. So verkürzen sich bei Stress die Dendriten von Neuronen. Dies wird als Grund für eine verminderte Aufmerksamkeit bei allostatischer Last gesehen.[5] Daneben kann chronischer Stress zu einer verstärkten Angstreaktion gegenüber Neuigkeiten führen.
Trotz der erhöhten Cortisolkonzentration führt chronischer Stress im Immunsystem zu vermehrter Inflammation. Ursächlich ist eine verstärkte Aktivierung des sympathoadrenergen Systems.[5]
Die genannten Reaktionen können als primäre Stressmediatoren zusammen mit sekundären Biomarkern der allostatischen Reaktion quantitativ erfasst und zu einem Summen-Score für die allostatische Last zusammengefasst werden.
Beziehung zur Allostase und Homöostase
Stress ist der Hauptfaktor, der zur allostatischen Last beiträgt. Grundsätzlich ist die Allostase ein Mechanismus, der die Möglichkeiten der Homöostase erweitert[13]. Homöostatische Systeme regulieren mit konstantem Sollwert den Zustand im Körper und der äußeren Umwelt.[13] Der Unterschied zwischen reiner Homöostase und Allostase liegt im Konzept der Vorhersage. Letztere kann die Freisetzung von Mediatoren wie Cortisol, TSH, Prolaktin etc. stimulieren. Exzessive Mediatorenkonzentrationen können zu allostatischer Last und Angst führen.[13]
Drei physiologische Prozesse können die allostatische Last erhöhen:
- Häufiger Stress: Die Höhe und Frequenz der Stressantwort bestimmt die Höhe der allostatischen Last.
- Fehlendes "Abschalten": Die Unfähigkeit des Körpers, sich zu entspannen, während Stressmediatoren ein hohes Niveau einnehmen und beispielsweise den Blutdruck erhöhen.
- Inadäquate Antwort: Die Unfähigkeit des Körpers, auf Belastungen wie Inflammation durch Glukokortikoide zu reagieren.
Eine fehlende Abstimmung zwischen homöostatischen und allostatischen Mechanismen kann über eine allostatische Last schließlich zur allostatischen Überlast führen, die durch Dekompensation Erkrankungen auslöst. Die kann ebenfalls durch Indizies der allostatischen Last quantifiziert werden[14].
Für statistische Zwecke steht das R-Paket DOREMI[15] zur Verfügung, mit dem die Dynamik eines homöostatischen Systems unter dem Einfluss externer Einflüsse modelliert werden kann.
Ursachen der allostatischen Last
Eine allostatische Last vom Typen 1 spiegelt die adaptive Antwort des Organismus auf einen absoluten Mangel an Energie, Glutathion und Makroelementen wider. Dies schließt auch prädiktive Reaktionen, z. B. im Winterschlaf, bei Infekten und bei Depression, ein[7][8][9].
Die allostatische Last vom Typen 2 rührt von einem Missverhältnis zwischen Versorgung und erwartetem Bedarf an Energie her. Sie wird durch psychosozialen Stress, z. B. in Form eines niedrigen sozioökonomischen Status, größerer Lebenskrisen und Stressoren aus der Umwelt, ausgelöst[14]. Dieser Zusammenhang erklärt das erhöhte Risiko für kardiovaskuläre Erkrankungen und chronische Krankheiten wie Adipositas, Diabetes mellitus Typ 2, arterielle Hypertonie und Erkrankungen aus dem psychotischen Formenkreis gerade bei Personen, die psychosozialen Traumen, Benachteiligung und Diskriminierung ausgesetzt waren[3][16]. Soziokulturelle Mechanismen sind geeignet, diese Verhältnisse noch zu zementieren, etwa indem sie die Gerechtigkeit der Gesundheitsversorgung beeinträchtigen[17][18].
Gesundheitliche Auswirkungen der allostatischen Last
Eine erhöhte allostatische Last stellt einen signifikanten gesundheitlichen Risikofaktor dar. Mehrere Studien haben einen starken Zusammenhang zwischen der allostatischen Last und Surrogatmarkern für die kardiovaskuläre Gesundheit[19][20][21][22] sowie der Inzidenz einer koronaren Herzerkrankung[23] und schließlich harten Endpunkten, insbesondere der krankheitsspezifischen und allgemeinen Mortalität[24][25] dokumentiert. Physiologische Mediatoren, welche die allostatische Last mit Mortalität und Morbidität verknüpfen, schließen u. a. das autonome Nervensystem[26], Zytokine und Stresshormone wie Katecholamine[27][28], Cortisol[29][30][31][32] und Schilddrüsenhormone[33] ein.
Risikoreduktion
Durch Beachtung struktureller und psychologischer Faktoren kann die allostatische Last individuell reduziert und beherrscht werden. Hierzu gehören beispielsweise die soziale Umwelt und der Zugang zu Gesundheitsdienstleistungen. Verhaltensfaktoren schließen lebensstilmodifizierende Maßnahmen wie Ernährung, Bewegung und Tabakverzicht ein.[4] Durch frühzeitige Intervention kann daher die Entwicklung chronischer Erkrankungen verhindert werden.
Ein niedriger sozioökonomischer Status erhöht die allostatische Last, so dass Maßnahmen zur Verminderung der gesellschaftlichen Polarisation und zur Verbesserung sozialer Kontakte und psychischer Randbedingungen die allostatische Last auf Bevölkerungsebene reduzieren können[34].
Interventionen können auch in Aufklärungsmaßnahmen für eine verbesserte Schlafqualität und -quantität, einen gesunden Lebensstil und anderweitiger sozialer Unterstützung bestehen[35].
Die Beziehung zwischen Stress und allostatischer Last unterscheidet sich nach Geschlecht, Alter und sozialem Status der betroffenen Person, so dass personalisierte Maßnahmen sinnhaft sind,[4] die auch Bildungsmaßnahmen und die Gestaltung von Arbeitsplätzen einschließen sollten.[35][4]
Siehe auch
Weblinks
- Bruce McEwen: Vortrag zum Konzept der allostatischen Last. (englisch)
- Kurze Erklärung des Konzepts. (deutsch)
Einzelnachweise
- Jane Ogden: Health Psychology: A textbook, 3rd edition. Open University Press - McGraw-Hill Education, 2004, ISBN 978-0-335-21471-6, S. 259.
- B.S. McEwen, E. Stellar: Stress and the individual. Mechanisms leading to disease.. In: Archives of Internal Medicine. 153, Nr. 18, 27. September 1993, S. 2093–101. doi:10.1001/archinte.153.18.2093. PMID 8379800.
- P. Sterling: Allostasis: a model of predictive regulation.. In: Physiology & Behavior. 106, Nr. 1, 12. April 2012, S. 5–15. doi:10.1016/j.physbeh.2011.06.004. PMID 21684297.
- H.M. Schenk, B.F. Jeronimus, L. van der Krieke, E.H. Bos, P. de Jonge, J.G. Rosmalen: Associations of Positive Affect and Negative Affect With Allostatic Load: A Lifelines Cohort Study. In: Psychosomatic Medicine. 80, Nr. 2, 2017, S. 160–166. doi:10.1097/PSY.0000000000000546.
- A. Danese, B.S. McEwen: Adverse childhood experiences, allostasis, allostatic load, and age-related disease.. In: Physiology & Behavior. 106, Nr. 1, 12. April 2012, S. 29–39. doi:10.1016/j.physbeh.2011.08.019. PMID 21888923.
- A. Peters, B.S. McEwen, K. Friston: Uncertainty and stress: Why it causes diseases and how it is mastered by the brain.. In: Progress in Neurobiology. 156, September 2017, S. 164–188. doi:10.1016/j.pneurobio.2017.05.004. PMID 28576664.
- AL Brame, M Singer: Stressing the obvious? An allostatic look at critical illness.. In: Critical care medicine. 38, Nr. 10 Suppl, Oktober 2010, S. S600-7. doi:10.1097/CCM.0b013e3181f23e92. PMID 21164403.
- JM Cuesta, M Singer: The stress response and critical illness: a review.. In: Critical care medicine. 40, Nr. 12, Dezember 2012, S. 3283-9. doi:10.1097/CCM.0b013e31826567eb. PMID 22975887.
- A Chatzitomaris, R Hoermann, JE Midgley, S Hering, A Urban, B Dietrich, A Abood, HH Klein, JW Dietrich: Thyroid Allostasis-Adaptive Responses of Thyrotropic Feedback Control to Conditions of Strain, Stress, and Developmental Programming.. In: Frontiers in endocrinology. 8, 2017, S. 163. doi:10.3389/fendo.2017.00163. PMID 28775711.
- BS McEwen, JC Wingfield: The concept of allostasis in biology and biomedicine.. In: Hormones and behavior. 43, Nr. 1, Januar 2003, S. 2–15. PMID 12614627.
- JW Dietrich, R Hoermann, JE Midgley, F Bergen, P Müller: The Two Faces of Janus: Why Thyrotropin as a Cardiovascular Risk Factor May Be an Ambiguous Target. In: Frontiers in Endocrinology. 11, 26. Oktober 2020, S. 542710. doi:10.3389/fendo.2020.542710. PMID 33193077. PMC 7649136 (freier Volltext).
- Ashley Edes, Douglas Crews: Allostatic load and biological anthropology. In: American Journal of Physical Anthropology. 162, 1. Januar 2017, S. 44–70. doi:10.1002/ajpa.23146. PMID 28105719.
- BS McEwen: Stress, adaptation, and disease. Allostasis and allostatic load.. In: Annals of the New York Academy of Sciences. 840, 1. Mai 1998, S. 33–44. doi:10.1111/j.1749-6632.1998.tb09546.x. PMID 9629234.
- McEwen B. S.: Allostasis and allostatic load: implications for neuropsychopharmacology. In: Neuropsychopharmacology. 22, Nr. 2, 2000, S. 108–24. doi:10.1016/S0893-133X(99)00129-3. PMID 10649824.
- DOREMI cran.r-project.org
- J Guidi, M Lucente, N Sonino, GA Fava: Allostatic Load and Its Impact on Health: A Systematic Review.. In: Psychotherapy and psychosomatics. 90, Nr. 1, 2021, S. 11–27. doi:10.1159/000510696. PMID 32799204.
- AC Falkentoft, J Andersen, ME Malik, C Selmer, PH Gæde, PB Staehr, MA Hlatky, E Fosbøl, L Køber, C Torp-Pedersen, GH Gislason, TA Gerds, M Schou, NE Bruun, AC Ruwald: Impact of socioeconomic position on initiation of SGLT-2 inhibitors or GLP-1 receptor agonists in patients with type 2 diabetes - a Danish nationwide observational study.. In: The Lancet regional health. Europe. 14, March 2022, S. 100308. doi:10.1016/j.lanepe.2022.100308. PMID 35146474. PMC PMC8802041 (freier Volltext).
- MA Nauck, JW Dietrich: Understanding the restrictions in the prescription and use of potentially beneficial diabetes medications associated with low socio-economic status.. In: The Lancet regional health. Europe. 14, March 2022, S. 100318. doi:10.1016/j.lanepe.2022.100318. PMID 35146476. PMC PMC8819377 (freier Volltext).
- G Veronesi, M Cavicchiolo, MM Ferrario: Allostatic load as a mediator of the association between psychosocial risk factors and cardiovascular diseases. Recent evidence and indications for prevention.. In: Giornale italiano di medicina del lavoro ed ergonomia. 41, Nr. 4, Dezember 2019, S. 333–336. PMID 32126604.
- M Viljoen, N Claassen: Allostatic load and heart rate variability as health risk indicators.. In: African health sciences. 17, Nr. 2, Juni 2017, S. 428–435. doi:10.4314/ahs.v17i2.17. PMID 29062338.
- LL Magnusson Hanson, NH Rod, J Vahtera, M Virtanen, J Ferrie, M Shipley, M Kivimäki, H Westerlund: Job insecurity and risk of coronary heart disease: Mediation analyses of health behaviors, sleep problems, physiological and psychological factors.. In: Psychoneuroendocrinology. 118, August 2020, S. 104706. doi:10.1016/j.psyneuen.2020.104706. PMID 32460194.
- E Milad, T Bogg: Personality Traits, Coping, Health-related Behaviors, and Cumulative Physiological Health in a National Sample: 10 Year Prospective Effects of Conscientiousness via Perceptions of Activity on Allostatic Load.. In: Annals of behavioral medicine: a publication of the Society of Behavioral Medicine. 54, Nr. 11, 1. November 2020, S. 880–892. doi:10.1093/abm/kaaa024. PMID 32359064.
- SL Gillespie, CM Anderson, S Zhao, Y Tan, D Kline, G Brock, J Odei, E O’Brien, M Sims, SA Lazarus, DB Hood, KP Williams, JJ Joseph: Allostatic load in the association of depressive symptoms with incident coronary heart disease: The Jackson Heart Study.. In: Psychoneuroendocrinology. 109, November 2019, S. 104369. doi:10.1016/j.psyneuen.2019.06.020. PMID 31307010.
- LN Borrell, E Rodríguez-Álvarez, FJ Dallo: Racial/ethnic inequities in the associations of allostatic load with all-cause and cardiovascular-specific mortality risk in U.S. adults.. In: PloS one. 15, Nr. 2, 2020, S. e0228336. doi:10.1371/journal.pone.0228336. PMID 32053626.
- T Robertson, G Beveridge, C Bromley: Allostatic load as a predictor of all-cause and cause-specific mortality in the general population: Evidence from the Scottish Health Survey.. In: PloS one. 12, Nr. 8, 2017, S. e0183297. doi:10.1371/journal.pone.0183297. PMID 28813505.
- DS Goldstein: The extended autonomic system, dyshomeostasis, and COVID-19.. In: Clinical autonomic research: official journal of the Clinical Autonomic Research Society. 30, Nr. 4, August 2020, S. 299–315. doi:10.1007/s10286-020-00714-0. PMID 32700055.
- DN Brindley, Y Rolland: Possible connections between stress, diabetes, obesity, hypertension and altered lipoprotein metabolism that may result in atherosclerosis.. In: Clinical science (London, England: 1979). 77, Nr. 5, November 1989, S. 453-61. doi:10.1042/cs0770453. PMID 2684477.
- T Rigney: Allostatic load and delirium in the hospitalized older adult.. In: Nursing research. 59, Nr. 5, September 2010, S. 322-30. doi:10.1097/NNR.0b013e3181ec156b. PMID 20671582.
- ML Skinner, EA Shirtcliff, KP Haggerty, CL Coe, RF Catalano: Allostasis model facilitates understanding race differences in the diurnal cortisol rhythm.. In: Development and psychopathology. 23, Nr. 4, November 2011, S. 1167-86. doi:10.1017/S095457941100054X. PMID 22018088.
- EK Adam, JA Heissel, KH Zeiders, JA Richeson, EC Ross, KB Ehrlich, DJ Levy, M Kemeny, AB Brodish, O Malanchuk, SC Peck, TE Fuller-Rowell, JS Eccles: Developmental histories of perceived racial discrimination and diurnal cortisol profiles in adulthood: A 20-year prospective study.. In: Psychoneuroendocrinology. 62, Dezember 2015, S. 279-91. doi:10.1016/j.psyneuen.2015.08.018. PMID 26352481.
- JL Price, IR Frazier, B Lewis, R Walker, MA Javors, SJ Nixon, B Adinoff: Differences in pituitary-adrenal reactivity in Black and White men with and without alcohol use disorder.. In: Psychoneuroendocrinology. 100, Februar 2019, S. 180–189. doi:10.1016/j.psyneuen.2018.10.004. PMID 30347319.
- SG Casavant, X Cong, RH Fitch, J Moore, T Rosenkrantz, A Starkweather: Allostatic Load and Biomarkers of Stress in the Preterm Infant: An Integrative Review.. In: Biological research for nursing. 21, Nr. 2, März 2019, S. 210–223. doi:10.1177/1099800418824415. PMID 30654634.
- A Aweimer, I El-Battrawy, I Akin, M Borggrefe, A Mügge, PC Patsalis, A Urban, M Kummer, S Vasileva, A Stachon, S Hering, JW Dietrich: Abnormal thyroid function is common in takotsubo syndrome and depends on two distinct mechanisms: results of a multicentre observational study.. In: Journal of internal medicine. 12. November 2020. doi:10.1111/joim.13189. PMID 33179374.
- M. Kristenson, H.R. Eriksen, J.K Sluiter, D Starke, H Ursin: Psychobiological mechanisms of socioeconomic differences in health. In: Social Science & Medicine. 58, Nr. 8, April 2004, ISSN 0277-9536, S. 1511–1522. doi:10.1016/s0277-9536(03)00353-8. PMID 14759694.
- Robert-Paul Juster, Bruce S. McEwen, Sonia J. Lupien: Allostatic load biomarkers of chronic stress and impact on health and cognition. In: Neuroscience & Biobehavioral Reviews. 35, Nr. 1, September 2010, ISSN 0149-7634, S. 2–16. doi:10.1016/j.neubiorev.2009.10.002. PMID 19822172.