1,3-Cyclopentandion
1,3-Cyclopentandion ist eine chemische Verbindung aus der Gruppe der Ketone und neben 1,2-Cyclopentandion eines der beiden möglichen Cyclopentandione. Nach DFT-Rechnungen ist die Enolform um 1–3 kcal/mol günstiger als die Diketo-Form.[2] Die Enol-Form wurde durch Röntgenstrukturanalyse bestätigt.[3]
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
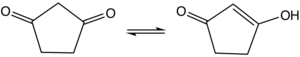 | |||||||||||||||||||
| Diketon-Form (links), Enol-Form (rechts) | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | 1,3-Cyclopentandion | ||||||||||||||||||
| Summenformel | C5H6O2 | ||||||||||||||||||
| Kurzbeschreibung |
weißes Pulver[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 98,04 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Vorkommen
Es wird behauptet, dass 1,3-Cyclopentandion beim Abbau von Chlortetracyclin (Aureomycin) entstehen kann.[4] Der Mechanismus hierzu ist jedoch nicht bekannt.
Synthese
Synthetisch gewonnen wurde 1,3-Cyclopentandion zuerst 1952 von Boothe et al.[4], welcher hierzu Ethyl-methyl-β-ketoadipat[5] in Ethylenglykol unter Zusatz von para-Toluolsulfonsäure und Benzol löste und diese Mischung vier Stunden in einer Apparatur mit Wasserabscheider zum Rückfluss erhitzte. Das Zwischenprodukt arbeitete er basisch auf und erhitzte es erneut für 45 min. Nach saurer Aufarbeitung erhitzte er die nun wässrige Lösung noch 1,5 h und engte im Vakuum ein. Aus dem öligen Rückstand gewann er durch destillative Aufreinigung das 1,3-Cyclopentandion in sehr schlechter Ausbeute (7,5 %). Daraus, dass sich der Schmelzpunkt der Substanz nach Mischen mit dem Chlortetracyclin-Abbauprodukt nicht verändert, schloss er darauf, dass es sich bei dem Abbauprodukt ebenfalls um 1,3-Cyclopentandion handeln müsse.
Eine Synthese von 1972 ist die Reduktion von 4-Cyclopenten-1,3-dion[6] mit Zink in Essigsäure.[7][8]
Eigenschaften
Durch die β-Stellung der Carbonylgruppen ist 1,3-Cyclopentandion C–H-acide. Die Acidität ist mit einem pKa von 4,5 ähnlich der von Essigsäure.[4]
Einzelnachweise
- Datenblatt 1,3-Cyclopentanedione bei Sigma-Aldrich, abgerufen am 16. Februar 2022 (PDF).
- K. Jana, B. Ganguly: DFT study to explore the importance of ring size and effect of solvents on the keto–enol tautomerization process of α-and β-cyclodiones. In: ACS omega. Band 3, Nr. 7, 2018, S. 8429–8439, doi:10.1021/acsomega.8b01008.
- A. Katrusiak: Structure of 1,3-cyclopentanedione. In: Acta Cryst. Band 46, Nr. 7, 1990, S. 1289–1293, doi:10.1107/S0108270189011352.
- J. H. Boothe, R. G. Wilkinson, S. Kushner, J. H. Williams: Synthesis of Aureomycin Degradation Products. II. In: JACS. Band 75, Nr. 7, 1952, S. 1732–1733, doi:10.1021/ja01103a505.
- Externe Identifikatoren von bzw. Datenbank-Links zu Ethyl-methyl-β-ketoadipat: CAS-Nummer: 14000-78-3, PubChem: 12966142.
- Externe Identifikatoren von bzw. Datenbank-Links zu 4-cyclopentene-1,3-dione: CAS-Nummer: 930-60-9, EG-Nummer: 213-219-3, ECHA-InfoCard: 100.012.018, PubChem: 70258, ChemSpider: 63443, Wikidata: Q27285950.
- J. M. McIntosh, P. Beaumier: Improved preparation of 1,3-cyclopentanedione. In: J. Org. Chem. Band 37, Nr. 18, 1972, S. 2905–2906, doi:10.1021/jo00983a027.
- H. O. House, E. F. Zaweski, C. H. DePuy: 2-CYCLOPENTENE-1,4-DIONE. In: Org. Synth. Band 42, 1962, S. 36, doi:10.15227/orgsyn.042.0036.