Zona pellucida
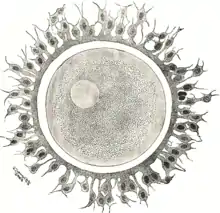
Die Zona pellucida oder Glashaut, früher auch Zona striata genannt, ist eine Schutzhülle um die Eizelle (Ovozyte) bei allen Wirbeltieren, die aus verschiedenen Glykoproteinen besteht. Sie wird von der Eizelle und den umgebenden kubischen Follikelepithelzellen (Granulosazellen) des Primärfollikels gebildet und liegt zwischen der Zellmembran der Eizelle und der inneren Schicht von Granulosazellen, die als Corona radiata bezeichnet wird.
| Übergeordnet |
| Zellperipherie |
| Gene Ontology |
|---|
| QuickGO |
Aufbau
Die Zona pellucida ist eine im Mittel etwa 17 µm dicke extrazelluläre Matrix aus Glykoproteinen, beim Menschen aus den Zona-pellucida-Proteinen ZP1, ZP2, ZP3 und ZP4 (bei der Maus nur ZP1, ZP2, ZP3). Sie umhüllt die wachsende Eizelle und wird von anliegenden Granulosazellen des Follikelepithels mit cytoplasmatischen Fortsätzen fingerartig durchdrungen, die in unmittelbarem Kontakt mit der Eizelle stehen (Gap Junctions). Die von der Eizelle synthetisierten Glykoproteine werden (nach Abtrennung eines C-terminalen Aminosäureanteils) aus der Zelle abgegeben. Die Proteine ZP2, ZP3 und ZP4 können dann lange Filament-Ketten bilden, die vorwiegend durch ZP1 miteinander zu einem dreidimensionalen Maschenwerk quer verbunden werden („cross link“). Der schmale Spaltraum zwischen Eizelle und Zona pellucida wird perivitelliner Raum genannt.
Funktion
Von entscheidender Bedeutung ist die Zona pellucida bei der eigentlichen Befruchtung. Die initiale (primäre) Bindung der Samenzelle an das Protein ZP3 leitet die Akrosomreaktion ein: Die im Akrosom des Spermiums befindlichen hydrolisierenden Enzyme – im Wesentlichen die Protease Akrosin – führen zu einer punktuellen Auflösung der Zona pellucida, was jetzt die sekundäre Bindung der Samenzelle an das Protein ZP2 und in der Folge den Eintritt der Samenzelle in die Eizelle ermöglicht. Die Zona pellucida selbst wird vom Spermium in einer Zeitspanne von ca. 20 Minuten durchdrungen.
Bei der ersten Berührung der beiden Keimzellen (das heißt der Ei- und Samenzelle) werden gleichzeitig verschiedene Reaktionen eingeleitet: Der Anteil der Zona pellucida an diesen Vorgängen besteht in der sogenannten Reaktion der Zona pellucida – der sofortigen Änderung ihrer Struktur bzw. ihrer spezifischen Membranrezeptoren. Andererseits werden aus Vesikeln im Randbereich des Zytoplasmas der Eizelle Proteasen in den perivitellinen Raum zwischen Eizelle und Zona pellucida entleert, was als kortikale Reaktion oder kortikale Degranulation – bezeichnet wird und die enzymatische Spaltung des ZP2 und somit dessen Inaktivierung bewirkt. Beide Vorgänge gemeinsam gewährleisten das sogenannte zona hardening in dem Augenblick, in dem mehr als 16 % des vorhandenen ZP2 inaktiviert wurde, womit kein weiteres Spermium in die Eizelle gelangen kann (es nicht zur Polyspermie kommt). Des Weiteren dient die veränderte Zona pellucida dem Schutz des frühen Embryos vor der Implantation.
Eine wichtige Rolle bei der Regulation der Zona pellucida besitzt auch das Fetuin B; das Protein hemmt dabei Ovastacin, welches die Zona pellucida auch schon vor dem Eindringen eines Spermiums verhärten lässt. Weibliche Mäuse ohne Fetuin-B sind – trotz normaler Entwicklung und Funktion der Eierstöcke – unfruchtbar.[1][2]
Pathologie
Erstmals wurde 2014 bei einer chinesischen Han-Familie eine autosomal-rezessive Mutation eines ZP-Proteins und fehlender Zona pellucida mit familiärer Infertilität in Verbindung gebracht. Dabei wurde bei sechs infertilen Familienmitgliedern eine homozygote Frameshift-Mutation festgestellt, die zu einem vorzeitigen Strangabbruch des ZP1-Proteins durch ein Stopcodon und zu einem fehlenden C-terminalen Proteinende führt.[3] Das normale ZP1-Protein umfasst bei der Synthese 638 Aminosäuren, wobei der in der Matrix ausgeschiedene Anteil den Aminosäuren 279 bis 549 entspricht. Durch Deletion von acht Basenpaaren (Nukleotide 1169 bis 1176) erfolgt ab Aminosäure 390 eine nicht homologe Transkription, beginnend mit Threonin statt Isoleucin an Stelle 390 und abgeschlossen durch ein Stopcodon nach Position 404: abgekürzt "I390fs404X". Durch die Mutation umfasst das Gesamtprotein also nur 404 Aminosäuren, von denen die letzten 15 Aminosäuren keine Homologie zum normalen Protein mehr aufweisen.
Siehe auch
- Ovarialfollikel
- Zona-pellucida-Autoantikörper
Einzelnachweise
- Fruchtbarkeit: Wichtiger Mechanismus gefunden. Meldung bei DocCheck vom 19. April 2013.
- Eileen Dietzel u. a.: Fetuin-B, a Liver-Derived Plasma Protein Is Essential for Fertilization. In: Developmental Cell. Vol. 25(1), S. 106–112, 4. April 2013, doi:10.1016/j.devcel.2013.03.001.
- Hua-Lin Huang, Chao Lv, Ying-Chun Zhao, Wen Li, Xue-Mei He, Ping Li, Ai-Guo Sha, Xiao Tian, Christopher J. Papasian, Hong-Wen Deng, Guang-Xiu Lu, Hong-Mei Xiao: Mutant ZP1 in Familial Infertility. In: New England Journal of Medicine. 2014, Band 370, Ausgabe 13 vom 27. März 2014, S. 1220–1226; doi: 10.1056/NEJMoa1308851