Silbernitrid
Silbernitrid ist eine anorganische chemische Verbindung des Silbers aus der Gruppe der Nitride.
| Strukturformel | |||||||
|---|---|---|---|---|---|---|---|
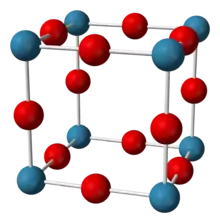 | |||||||
| _ N3− _ Ag+ | |||||||
| Allgemeines | |||||||
| Name | Silbernitrid | ||||||
| Andere Namen |
Knallsilber (mehrdeutig) | ||||||
| Summenformel | Ag3N | ||||||
| Kurzbeschreibung |
schwarzer Feststoff[1] | ||||||
| Externe Identifikatoren/Datenbanken | |||||||
| |||||||
| Eigenschaften | |||||||
| Molare Masse | 337,61 g·mol−1 | ||||||
| Aggregatzustand |
fest | ||||||
| Dichte |
9,0 g·cm−3[1] | ||||||
| Sicherheitshinweise | |||||||
| |||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||
Gewinnung und Darstellung
Silbernitrid kann durch Reaktion von Silber(I)-oxid mit Ammoniak in Ethanol gewonnen werden.[1]
Eigenschaften
Silbernitrid ist ein schwarzer flockiger Feststoff, der schwerlöslich in kaltem Wasser ist. Er ist löslich unter Zersetzung in verdünnten Mineralsäuren. Mit konzentrierten Säuren erfolgt eine explosionsartige Reaktion. An Luft beginnt bei 25 °C eine langsame Zersetzung, ab einer Temperatur von etwa 165 °C erfolgt der Zerfall explosionsartig. Die Verbindung ist sehr empfindlich gegen mechanische Einflüsse auch im feuchten Zustand. Silbernitrid besitzt eine kubisch-flächenzentrierte Kristallstruktur und eine Bildungsenthalpie von +199,1 kJ/mol.[1] Das Kristallgitter (a = 4,369 Å) wird durch die kubisch-flächenzentrierte Anordnung der Silberatome gebildet, in deren Oktaederlücken sich der Stickstoff befindet.[3]
Einzelnachweise
- Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band II, Ferdinand Enke, Stuttgart 1978, ISBN 3-432-87813-3, S. 1003.
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- Harry Hahn, Edmund Gilbert: Silbernitrid. Metallamide und Metallnitride, 19. Mitteilung. In: Zeitschrift für anorganische Chemie. 258, 1949, S. 77–93, doi:10.1002/zaac.19492580109.