Signalpeptidase
Signalpeptidasen, auch Signalasen, sind proteinspaltende Enzyme (Proteasen), die an der Membran des Endoplasmatischen Retikulums (ER) innerhalb der Zelle lokalisiert sind. Die Signalpeptidase erkennt spezielle Aminosäuresequenzen (Signalsequenzen) innerhalb eines Proteins. Sie spaltet im Lumen des ER das Signalpeptid von der restlichen Polypeptidkette ab.
Struktur
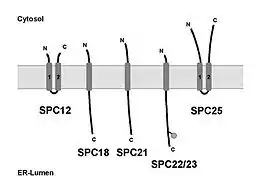
Bei Säugetieren setzt sich das Enzym aus fünf Membranproteinen zusammen (siehe Abb.). Die Untereinheiten SPC12, SPC18, SPC21, SPC22/23 und SPC25 wurden jeweils nach ihrer in der Gelelektrophorese (SDS-PAGE) bestimmten Molekülmasse in Kilodalton benannt. Drei Proteine, SPC18, SPC21 und SPC22/23 besitzen jeweils nur ein Transmembransegment zur Verankerung in der Membran des ER, wobei der N-Terminus im Cytosol und der Großteil des Proteins zusammen mit dem C-Terminus im Lumen des ER lokalisiert ist. Bei SPC18 und SPC21 handelt es sich um fast identische Proteine, sie stellen mit 80 % übereinstimmenden Aminosäuren Isoformen zueinander dar. SPC22/23 ist ein Glykoprotein, das in der SDS-PAGE als Doppelbande bei 22 kDa und 23 kDa läuft. Die Masse von SPC22/23 ohne Glykosylierung beträgt 19 kDa. Die Untereinheiten SPC25 und SPC12 besitzen je zwei Transmembransegmente, wobei die C- und N-Termini der Proteine im Cytoplasma lokalisiert sind. Des Weiteren ist der Abstand zwischen dem Membranankern in beiden Proteinen so gering, dass SPC25 und SPC12 kaum luminale Bereiche besitzen. SPC18 und SPC21 sind vermutlich Bestandteile des aktiven Zentrums der Signalpeptidase. Außer im Säuger wurde die Signalpeptidase auch im Vogel und in der Hefe näher charakterisiert. Aus Huhn-Eileiterzellen wurde ein Signalpeptidase-Komplex gereinigt, der nur aus den zwei Membranproteinen gp23 und p19 besteht. Das gp23 ist homolog zur Säuger-Untereinheit SPC22/23 und p19 ist homolog zu SPC18.
Eukaryotische und prokaryotische Signalpeptidasen
Alle Signalpeptidasen, die N-terminale Signalpeptide abspalten, werden in der Gruppe der Typ I Signalpeptidasen zusammengefasst. Dazu gehören unter anderem die bakteriellen Leader-Peptidasen, die mitochondrialen Signalpeptidasen der inneren Membran sowie die ER-Signalpeptidasen. Die Substratspezifität der Typ I Signalpeptidasen ist stark konserviert: prokaryotische Leader-Peptidasen können Signalsequenzen von eukaryotischen Transportsubstraten abspalten, so wie auch umgekehrt eukaryotische Signalpeptidasen prokaryotische Transportsubstrate spalten können. Im Gegensatz zu den eukaryotischen Signalpeptidasen bestehen jedoch die prokaryotischen Leader-Peptidasen jeweils nur aus einem Membranprotein, deren bekanntester Vertreter die Leader-Peptidase LepB aus E. coli ist. Sequenzvergleiche ergaben, dass mehrere Regionen im Hefe Sec11p sowie auch in den Säuger-Untereinheiten SPC21 und SPC18 Homologien zur bakteriellen Leaderpeptidase aufweisen.
Aktives Zentrum
Mittels Punktmutations-Studien an prokaryontischen Leader-Peptidasen konnte gezeigt werden, dass ein konservierter Serin-Rest sowie ein Lysin-Rest essentiell für die Spaltungsaktivität sind. Die Kristallstrukturanalyse der Leaderpeptidase aus E. coli ergab, dass der Serinrest an Position 90 zusammen mit Lysin an Position 145 das aktive Zentrum der Peptidase bilden. Im Gegensatz zu klassischen Serin-Endopeptidasen fungiert in den Leader-Peptidasen wahrscheinlich Lysin anstelle von Histidin als Base bei der Spaltungsreaktion. Interessanterweise ist in den eukaryotischen ER-Signalpeptidasen zwar der Serin-Rest konserviert, jedoch befindet sich beim Sequenzvergleich in der Position des Lysin ein Histidin. Punktmutations-Studien an Sec11p ergaben außerdem, dass keines der im Protein vorkommenden Lysine essentiell für die Spaltungsaktivität ist. Als essentiell für die Spaltung wurden hingegen Ser-44, His-83, Asp-103 und Asp-109 identifiziert, was eher für eine klassische Serin-Endopeptidase spricht. Bemerkenswert ist jedoch in diesem Zusammenhang, dass die ER-Signalpeptidasen von keinem der klassischen Serin-Protease-Inhibitoren (z. B. Aprotinin) inhibiert werden können.
Bedeutung
Die Spaltung von Proteinen durch membranständige Signalpeptidasen spielt eine bedeutende Rolle bei der posttranslationellen Prozessierung und Lokalisation von Proteinen. Dies gilt insbesondere auch für behüllten Viren, die an der Membran des ER reifen und deren Polyprotein zum Teil durch zelluläre Signalpeptidasen gespalten wird, z. B. Mitglieder der Virus-Familie Flaviviridae (BVDV, Hepatitis-C-Virus, Gelbfiebervirus).