Robinson-Gabriel-Synthese
Die Robinson-Gabriel-Synthese ist eine Namensreaktion aus dem Bereich der organischen Chemie und wurde 1907 von Siegmund Gabriel (1851–1924) und 1909 von Robert Robinson (1886–1975) beobachtet. Dabei findet eine intramolekulare Kondensation und Dehydrierung von N-Acyl-α-aminoketonen zu Oxazolen statt.[1]
Übersichtsreaktion
Die Robinson-Gabriel-Synthese wird unter dehydrierenden Reagenzien wie Schweflige Säure oder Phosphorpentachlorid (PCl5) ausgeführt.
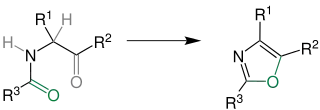
Die grau eingezeichneten Atome verlassen bei der Reaktion das Molekül und es entsteht an der grün eingezeichneten ein Ringschluss. Die Reste R1,R2 und R3 stehen für organische Reste.
Möglicher Mechanismus
Der folgende Mechanismus der Robinson-Gabriel-Synthese wird allgemein für beliebige Reste R1, R2 und R3 mit abschließender Aufarbeitung durch Schweflige Säure erklärt.[1]

Die Carbonylgruppe der Ketogruppe vom N-Acyl-α-aminoketons 1 wird im ersten Schritt protoniert und reagiert zum Intermediat 2. Das Amidsauerstoffatom greift nukleophil wiederum an die Carbonylgruppe der Ketogruppe an und reagiert so zu einem Dihydrooxazolol 3. Durch die intermolekulare Kondensation entsteht das Hydrooxazol 4 und durch Dehydrierung durch die Schweflige Säure entsteht das 2,4,5-substituierte Oxazolderivat 5.
Anwendung
Die Robinson-Gabriel-Synthese dient der Herstellung von 2,5-disubstituierten oder 2,4,5-trisubstituierten Oxazolderivaten insbesondere 2,5-Diaryloxazolderivaten.
Literatur
- Zerong Wang: Comprehensive Organic Name Reactions and Reagents. John Wiley & Sons, Ney Jersey 2009, ISBN 978-0-471-70450-8, S. 2410–2413.
Einzelnachweise
- Zerong Wang: Comprehensive Organic Name Reactions and Reagents. First Edition, John Wiley & Sons, Ney Jersey 2009, ISBN 978-0-471-70450-8, S. 2410 f.