Rhodium(IV)-oxid
Rhodium(IV)-oxid, auch als Rhodiumdioxid bezeichnet, ist eine chemische Verbindung der Elemente Rhodium und Sauerstoff. Es ist ein schwarzer Feststoff; außerdem existiert ein grünes Hydrat.
| Kristallstruktur | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
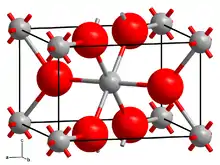 | ||||||||||||||||
| _ Rh4+ _ O2− | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Rhodium(IV)-oxid | |||||||||||||||
| Andere Namen |
Rhodiumdioxid | |||||||||||||||
| Verhältnisformel | RhO2 | |||||||||||||||
| Kurzbeschreibung | ||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 134,90 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte |
7,2 g·cm−3[1] | |||||||||||||||
| Schmelzpunkt |
Zersetzung[2] | |||||||||||||||
| Löslichkeit |
nahezu unlöslich in Wasser, Säuren, Alkalien und organischen Lösungsmitteln[2] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Gewinnung und Darstellung
Das Hydrat kann durch Oxidation von Rh2(SO4)3 mit z. B. Ozon oder durch Elektrolyse gewonnen werden.[4]
Eigenschaften
Physikalische Eigenschaften
Rhodium(IV)-oxid kristallisiert im tetragonalen Kristallsystem mit der Raumgruppe P42/mnm (Raumgruppen-Nr. 136) und den Gitterparametern a = 448,9 pm und c = 309,0 pm, in der Elementarzelle befinden sich zwei Formeleinheiten.[2]
Chemische Eigenschaften
Beim Erhitzen von Rhodiumdioxid auf 850 °C bildet sich Rhodiumtrioxid; dieses zerfällt bei 1050 °C in die Elemente.[4]
Literatur
- O. Muller and R. Roy: Formation and stability of the platinum and rhodium oxides at high oxygen pressures and the structures of Pt3O4, β-PtO2 and RhO2. In: Journal of the Less Common Metals. 16, 1968, S. 129. doi:10.1016/0022-5088(68)90070-2.
- R. D. Shannon: Synthesis and properties of two new members of the rutile family RhO2 and PtO2. In: Solid State Communications. 6, 1968, S. 139. doi:10.1016/0038-1098(68)90019-7.
Einzelnachweise
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Properties of the Elements and Inorganic Compounds, S. 4-85. (Rhodiumdioxid auf webelements.com).
- Jean D'Ans, Ellen Lax: Taschenbuch für Chemiker und Physiker. 3. Elemente, anorganische Verbindungen und Materialien, Minerale, Band 3. 4. Auflage, Springer, 1997, ISBN 978-3-5406-0035-0, S. 698 (eingeschränkte Vorschau in der Google-Buchsuche).
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1702.