ROMK
ROMK ist die Abkürzung für „Renal Outer Medullary Potassium (K) channel“ (englisch = ‚Kaliumkanal des äußeren Nierenmarks‘), einen Ionenkanal, der in der Niere eine wichtige Rolle bei der Ausscheidung von Kalium ausübt. ROMK wird durch das Gen KIR1.1 (KCNJ1) codiert. Pathologische Mutationen in diesem Gen führen zu schweren angeborenen Störungen des Kalium-Haushaltes. Entsprechende Krankheiten betreffen die Nierenkanälchen (Tubuli), die zusammen mit den Glomeruli das Nephron, die kleinste funktionelle Untereinheit der Niere, bilden. Bei solchen Tubulopathien kommt es nicht zur Niereninsuffizienz.
| ATP-sensitiver einwärts-gleichrichtender Kaliumkanal | ||
|---|---|---|
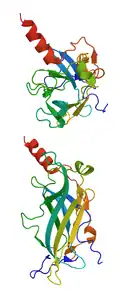 | ||
| Cytoplasma-Domäne eines einwärts-gleichrichtenden Kaliumkanals der Maus nach PDB 1N9P | ||
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 391 Aminosäuren; 44,8 kDa | |
| Sekundär- bis Quartärstruktur | multipass Membranprotein | |
| Isoformen | ROM-K1, ROM-K2, ROM-K3 | |
| Bezeichner | ||
| Gen-Name | KCNJ1 | |
| Externe IDs | ||
| Transporter-Klassifikation | ||
| TCDB | 1.A.2.1.1 | |
| Bezeichnung | Einwärts-gleichrichtende Kaliumkanäle | |
| Vorkommen | ||
| Übergeordnetes Taxon | Lebewesen | |
| Orthologe | ||
| Mensch | Maus | |
| Entrez | 3758 | 56379 |
| Ensembl | ENSG00000151704 | ENSMUSG00000041248 |
| UniProt | P48048 | O88335 |
| Refseq (mRNA) | NM_000220 | NM_019659 |
| Refseq (Protein) | NP_000211 | NP_062633 |
| Genlocus | Chr 11: 128.21 – 128.22 Mb | Chr 9: 32.2 – 32.21 Mb |
| PubMed-Suche | 3758 | 56379 |
Expression von ROMK in der Niere
In den Tubuli wird ROMK an zwei unterschiedlichen Abschnitten exprimiert und übt dort unterschiedliche Funktionen aus.
Im dicken aufsteigenden Teil (Schenkel) der Henle-Schleife werden Natrium und Kalium zunächst über den Na-K-2Cl Cotransporter aus dem Primärharn über die lumenseitige (apikale) Zellmembran in die Tubuluszelle transportiert. Während Natrium und Chlorid aus der Tubuluszelle über die lumenferne (basolaterale) Zellmembran weiter in das Blut transportiert werden (Rückresorption), gelangt das Kalium über ROMK in der apikalen Membran in den Primärharn zurück und steht dort erneut für den Transport von Natrium und Chlorid in die Zelle zur Verfügung. ROMK ist in der Henle-Schleife gewissermaßen für das Recycling von Kalium verantwortlich. Dieses Recycling begünstigt zum einen die Rückresorption von Kochsalz aus dem Primärharn in das Blut. Zum anderen führt das Kalium-Recycling über ROMK zum Anstieg positiver Ladung im Primärharn, und dies fördert wiederum den Transport von Calcium und Magnesium aus dem Primärharn in das Blut.
Im Sammelrohr wird ROMK ebenfalls in der apikalen Membran der Sammelrohrzelle exprimiert, ist dort aber für die Sekretion von Kalium aus dem Blut in den Urin verantwortlich. Im Sammelrohr wird über ROMK der größte Anteil des überschüssigen, über die Nahrung zugeführten Kaliums in den Urin ausgeschieden. Nimmt die Kalium-Aufnahme mit der Nahrung zu, steigt die Dichte von ROMK im Sammelrohr der Niere an. Dies wird als Anpassung an die Lebensweise unserer Vorfahren in der Altsteinzeit interpretiert, die eine Ernährung reich an Kalium und arm an Kochsalz zu sich genommen haben.[1]
Medizinische Bedeutung
Der Funktionsverlust von ROMK durch eine Mutation führt zum Bartter-Syndrom Typ II. Unmittelbar nach der Geburt weisen die betroffenen Kinder einen zu hohen Kaliumspiegel im Blut (Hyperkaliämie) auf, dies wird auf eine verminderte Ausscheidung von Kalium im Sammelrohr der Niere zurückgeführt. Im weiteren Verlauf der Erkrankung sinkt der Kalium-Spiegel im Blut ab, es kommt zur Hypokaliämie. Dies wird dadurch erklärt, dass in der Henle-Schleife das Recycling von Kalium über ROMK ausfällt, was wiederum die Rückresorption von Kochsalz, Calcium und Magnesium aus dem Primärharn in das Blut behindert. Die Natrium-Konzentration im Primärharn nimmt zu, im Sammelrohr steigt der Urinfluss. Dies führt dazu, dass in den Sammelrohrzellen ein zweiter Kalium-Kanal, der Maxi-Kalium-Kanal aktiviert wird, der bei normalem Fluss und normaler Kochsalzkonzentration geschlossen ist. Dies führt im Endeffekt zu einem Kaliumverlust über die Nieren und zum Abfall der Kaliumkonzentration im Blut.
Der zeitliche Verlauf der Erkrankung mit erhöhtem Kalium-Spiegel unmittelbar nach der Geburt und Abfall des Kaliums im weiteren Verlauf der Erkrankung wird dadurch erklärt, dass in der Entwicklung der Niere ROMK früher als Maxi-K+ exprimiert wird. Folgen der Erkrankung sind schwere Salz- und Kalium-Verluste über die Nieren, die bis zur Auflösung von Muskelzellen (Rhabdomyolyse) und zu periodischen Lähmungserscheinungen (Periodische Paralyse) führen können, sowie Wachstumsstörungen und Störungen der geistigen Entwicklung.[2]
Literatur
- Ulrich Kerl: Charakterisierung interagierender Proteine des renalen ATP-abhängigen Kaliumkanals ROMK. (Dissertation, Universität Würzburg, Medizinische Fakultät, 2005, Doktorarbeit bei Dokserv).
Quellen
- Wen-Hui Wang: Regulation of ROMK (Kir1.1) channels: new mechanisms and aspects. In: American Journal of Physiology-Renal Physiology. Band 290, Nr. 1, 9. Dezember 2005, S. F14–F19, doi:10.1152/ajprenal.00093.2005.
- M. A. Bailey, A. Cantone, Q. Yan, G. G. MacGregor, Q. Leng, J. B. O. Amorim, T. Wang, S. C. Hebert, G. Giebisch, G. Malnic: Maxi-K channels contribute to urinary potassium excretion in the ROMK-deficient mouse model of Type II Bartter’s syndrome and in adaptation to a high-K diet. In: Kidney International. Band 70, Nr. 1, 17. April 2006, S. 51–59.