Pyroxengruppe
Als Pyroxengruppe bezeichnet man eine Gruppe von Mineralen aus der Abteilung der Kettensilikate. Ihre Kristallstruktur zeichnet sich durch Einfachketten aus eckenverknüpften SiO4-Tetraedern aus und ihre Zusammensetzung genügt der folgenden verallgemeinerten Summenformel:
M1 M2 T2O6.
In dieser Strukturformel repräsentieren M1, M2 und T unterschiedliche Positionen in der Pyroxenstruktur. Sie werden vorwiegend durch folgende Kationen belegt:
- M1: Mg2+, Fe2+, Mn2+, Al3+, Fe3+, Ti4+, Ti3+, V3+, Sc3+, Cr3+, Zr4+, Zn2+,
- M2: Mg2+, Fe2+, Mn2+, Ca2+, Na+, Li+
- T: Si4+, Al3+, Fe3+
Fett hervorgehoben sind die dominierenden Kationen auf den einzelnen Positionen.
Die Zusammensetzungen der Pyroxene sind sehr variabel und sie treten weltweit in sehr vielen verschiedenen Paragenesen und geologischen Milieus auf. Sie sind wichtiger Bestandteil sowohl magmatischer wie auch metamorpher Gesteine unterschiedlichster Zusammensetzung und Bildungsbedingungen.
Pyroxene haben eine Härte zwischen 5 und 6,5 sowie eine bleichgrüne bis bräunlichgrüne oder bronzene Farbe. Strichfarbe ist ein grünliches Weiß.
Eine sehr ähnliche Mineralgruppe sind die Amphibole; Pyroxen unterscheidet sich von diesen jedoch in der Spaltbarkeit; die Spaltwinkel bei Pyroxenen liegen bei 90 Grad, während sie bei Amphibol 120 Grad betragen. Pyroxene bilden kurze Säulen, Amphibole dagegen meist lange. Idiomorphe Pyroxene haben zwei Kopfflächen, Amphibole hingegen drei.

Größe: 3,0 × 2,8 × 2,0 cm
Etymologie und Geschichte
Der Name Pyroxen stammt aus dem Griechischen von pyros (Feuer) und xenos (fremd). Er spielt darauf an, dass Pyroxene vor allem in Vulkanlava auftreten, wo sie als Kristalleinschlüsse von Vulkanglas gefunden werden können; früher wurde angenommen, es handele sich nur um Verunreinigungen des Glases, so dass der Name „Feuerfremde“ entstand. Tatsächlich aber handelt es sich bei den Pyroxenen um Minerale, die vor der Lavaeruption kristallisieren.
Klassifizierung und Nomenklatur
Basis einer korrekten Benennung eines Pyroxens ist eine vollständige chemische Analyse und die Anwendung eines vorgegebenen Berechnungsschemas, mit dem die genauen Gehalte der einzelnen Elemente normiert und auf die einzelnen Positionen (M1, M2, T) aufgeteilt werden.
Die Internationale Mineralogische Vereinigung (IMA) teilt die Pyroxene nach ihrer Zusammensetzung in 6 Gruppen ein:
- Mg-Fe-Pyroxene
- Mn-Mg-Pyroxene
- Ca-Pyroxene
- Ca-Na-Pyroxene
- Na-Pyroxene
- Li-Pyroxene
In diesen sechs Gruppen werden 20 Basisnamen für Pyroxene festgelegt. Bedeutenden Abweichungen von den im Anschluss aufgeführten Zusammensetzungen wird durch vorangestellte Adjektive (titanreich, eisenreich, …) Rechnung getragen.[1]
In den im Folgenden angegebenen Strukturformeln können sich die in Klammern stehenden Atome in beliebiger Mischung durch Substitution vertreten, stehen aber immer im selben Verhältnis zu den anderen Atomgruppen. Hier werden lediglich die idealisierten Zusammensetzungen der verschiedenen Pyroxene aufgeführt. Die Gültigkeit der Mineralnamen erstreckt sich jeweils über einen größeren Zusammensetzungsbereich. So werden z. B. alle Ca-armen Mg-Fe-Pyroxene mit Mg-Gehalten von 0 bis 1 Fe2+ als Enstatit bzw. Klinoenstatit bezeichnet.
Die Strukturformeln für Pigeonit, Augit, Omphacit und Aegirin-Augit beschreiben streng genommen Mischkristalle und keine Minerale. Die aktuellen Richtlinie für eine Mineral-Endgliedzusammensetzung erlaubt eine gemischte Besetzung nur einer Gitterposition mit maximal zwei verschiedenen Ionen.[2] Aus Rücksicht auf die große Verbreitung dieser Pyroxene und die breite Verwendung dieser Mineralnamen in der Literatur werden sie weiterhin als eigenständige Minerale geführt.[1]
Mg-Fe-Pyroxene
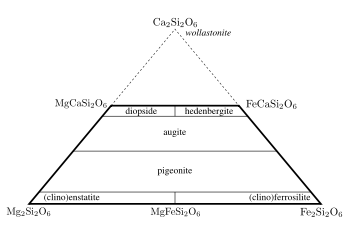
Mg-Fe-Pyroxene kommen sowohl mit orthorhombischer, als auch monokliner Symmetrie vor.
Folgende Endglieder bilden die Grenzen der Mg-Fe-Pyroxene:
| Name | M22+ | M12+ | T4+2 | O2-6 | Raumgruppe | Anmerkung |
|---|---|---|---|---|---|---|
| Enstatit | Mg2+ | Mg2+ | Si4+2 | O6 | Pbca (Nr. 61) | |
| Ferrosilit | Fe2+ | Fe2+ | Si4+2 | O6 | Pbca (Nr. 61) | |
| Protoenstatit | Mg2+ | Mg2+ | Si4+2 | O6 | Pbcn (Nr. 60) | |
| Protoferrosilit | Fe2+ | Fe2+ | Si4+2 | O6 | Pbcn (Nr. 60) | hypothetisch, ~20% in Protoenstatit[3] |
| Klinoenstatit | Mg2+ | Mg2+ | Si4+2 | O6 | P21/c (Nr. 14) | |
| Klinoferrosilit | Fe2+ | Fe2+ | Si4+2 | O6 | P21/c (Nr. 14) | |
| Pigeonit | (Ca, Mg, Fe)2+ | (Mg, Fe)2+ | Si4+2 | O6 | P21/c (Nr. 14) |
Mn-Mg-Pyroxene
Mg-Mn-Pyroxene kommen sowohl mit orthorhombischer, als auch monokliner Symmetrie vor.
| Name | M22+ | M12+ | T4+2 | O2-6 | Raumgruppe | Anmerkung |
|---|---|---|---|---|---|---|
| Donpeacorit | Mn2+ | Mg | Si4+2 | O6 | Pbca (Nr. 61) | |
| Kanoit | Mn2+ | Mg | Si4+2 | O6 | P21/c (Nr. 14) |
Ca-Pyroxene
Alle Ca-Pyroxene kristallisieren mit monokliner Symmetrie.
| Name | M22+ | M12+ | T4+2 | O2-6 | Raumgruppe | Anmerkung |
|---|---|---|---|---|---|---|
| Augit | (Ca, Mg, Fe2+) | (Mg, Fe2+) | Si4+2 | O6 | C2/c (Nr. 15) | |
| Diopsid | Ca2+ | Mg2+ | Si4+2 | O6 | C2/c (Nr. 15) | |
| Hedenbergit | Ca2+ | Fe2+ | Si4+2 | O6 | C2/c (Nr. 15) | |
| Johannsenit | Ca2+ | Mn2+ | Si4+2 | O6 | C2/c (Nr. 15) | |
| Petedunnit | Ca2+ | Zn2+ | Si4+2 | O6 | C2/c (Nr. 15) | |
| M22+ | M13+ | T3+T4+ | O2- | |||
| Kushiroit | Ca2+ | Al3+ | Al3+Si4+ | O6 | C2/c (Nr. 15) | |
| Esseneit | Ca2+ | Fe3+ | Al3+Si4+ | O6 | C2/c (Nr. 15) | |
| Burnettit | Ca2+ | V3+ | Al3+Si4+ | O6 | C2/c (Nr. 15) | |
| Davisit | Ca2+ | Sc3+ | Al3+Si4+ | O6 | C2/c (Nr. 15) | |
| Grossmanit | Ca2+ | Ti3+ | Al3+Si4+ | O6 | C2/c (Nr. 15) | |
| M22+ | M14+0,5M12+0,5 | T3+T4+ | O2- | |||
| Buffonit | Ca2+ | Ti4+0,5Mg2+0,5 | Fe3+Si4+ | O6 | hypothetisches Ti4+-Fe3+- Endglied[4] | |
| Al-Buffonit | Ca2+ | Ti4+0,5Mg2+0,5 | Al3+Si4+ | O6 | hypothetisches Ti4+-Al3+- Endglied[4] | |
| M22+0,5□0,5 | M13+ | T4+2 | O2- | |||
| Tissintit | Ca2+0,5□0,5 | Al3+ | Si4+2 | O6 | C2/c (Nr. 15) | |
| Chrom-Eskola-Pyroxen | Mg2+0,5□0,5 | Cr3+ | Si4+2 | O6 | hypothetisches Endglied[5] |
Ca-Na-Pyroxene
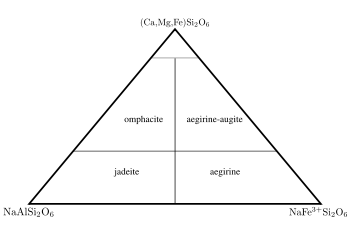
Omphacit kommt in der Natur in zwei verschiedenen Symmetrien vor. P2/n (Nr. 13, Stellung 2)-Omphacite unterscheiden sich strukturell von den übrigen Pyroxenen und können als eigene Spezies angesehen werden. C2/c (Nr. 15)-Omphacite können als Jadeit-Diopsid-Hedenbergit-Mischkristall betrachtet werden.[1]
Aegirin-Augit wurde bislang nur mit der Raumgruppe C2/c (Raumgruppen-Nr. 15) gefunden und kann als Aegirin-Diopsid-Hedenbergit-Mischkristall betrachtet werden.[1]
| Name | M22+0,5M2+0,5 | M12+0,5M13+0,5 | T4+2 | O2-6 | Raumgruppe | Anmerkung |
|---|---|---|---|---|---|---|
| Omphacit | Ca2+0,5Na+0,5 | (Mg, Fe)2+0,5Al3+0,5 | Si4+2 | O6 | C2/c (Nr. 15), P2/n (Nr. 13, Stellung 2) | |
| Aegirin-Augit | Ca2+0,5Na+0,5 | (Mg, Fe)2+0,5Fe3+0,5 | Si4+2 | O6 | C2/c (Nr. 15) |
Na-Pyroxene
| Name | M2+ | M13+ | T4+2 | O2-6 | Raumgruppe | Anmerkung |
|---|---|---|---|---|---|---|
| Jadeit | Na+ | Al3+ | Si4+2 | O6 | C2/c (Nr. 15) | |
| Aegirin | Na+ | Fe3+ | Si4+2 | O6 | C2/c (Nr. 15) | |
| Kosmochlor | Na+ | Cr3+ | Si4+2 | O6 | C2/c (Nr. 15) | |
| Jervisit | Na+ | Sc3+ | Si4+2 | O6 | C2/c (Nr. 15) | |
| Namansilit | Na+ | Mn3+ | Si4+2 | O6 | C2/c (Nr. 15) | |
| Natalyit | Na+ | V3+ | Si4+2 | O6 | C2/c (Nr. 15) |
Li-Pyroxene
| Name | M2+ | M13+ | T4+2 | O2-6 | Raumgruppe | Anmerkung |
|---|---|---|---|---|---|---|
| Spodumen | Li+ | Al3+ | Si4+2 | O6 | C2/c (Nr. 15) |
Die Zusammensetzungen natürlich auftretender Pyroxene liegen häufig zwischen den idealisierten Zusammensetzungen dieser Gruppen. Entsprechend wurde eine weitere, gröbere Einteilung entwickelt, die dieser komplexen Mischbarkeit von Kationen auf den Positionen M1 und M2 Rechnung trägt. Danach werden vier chemische Gruppen unterschieden:
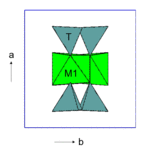
- Quaternäre Pyroxene (Abb. 1): Alle Ca-Mg-Fe-Pyroxene mit weniger als 0,2 Na (Enstatit, Ferrosilit, Pigeonit, Klinoenstatit, Klinoferrosilit, Diopsid, Hedenbergit, Augit). Die Symmetrie der Ca-reichen quaternären Pyroxene unterscheidet sich bei Raumtemperatur im Detail von derjenigen der Ca-armen Pyroxene. Die Unterscheidung zwischen Augit (monoklin in der Raumgruppe C2/m) und Pigenonit (monoklin in der Raumgruppe P21/c) erfolgt anhand dieses Wechsels in der Symmetrie. Augite und Pigeonite unterscheiden sich auch in ihren Ca-Gehalten. Daher wird für die Namensgebung meist die einfacher zu bestimmende Zusammensetzung herangezogen. Die Ca-Gehalte von Pigeonite ((Mg, Fe2+)1,9–1,6Ca0,1–0,4Si2AlO6) liegen unter 0,4 Atomen pro Formeleinheit (apfu) und die von Augite (Ca0,4–0,9(Mg,Fe2+)1,6–1,1Si2O6) darüber.
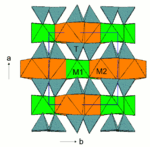
- Ca-Na-Pyroxene (Abb. 2): Ca-Mg-Fe-Pyroxene mit 0,2 bis 0,8 Na (Omphacit, Aegirin-Augit).
- Na-Pyroxene (Abb. 2): Al-Fe-Pyroxene mit 0,8 bis 1,0 Na (Jadeit, Aegirin).
- sonstige Pyroxene: Diese Gruppe enthält alle weiteren Pyroxene, von denen oft nur wenige Vorkommen mit außergewöhnlichen Zusammensetzungen geringer Variabilität bekannt sind (Spodumen, Essenit, Johannsenit, Petedunnit, Kanoit, Donpeacorit).
Nach der Symmetrie werden Pyroxene weiterhin in zwei Gruppen unterteilt:
- Klinopyroxene: Pyroxene mit monokliner Symmetrie
- Orthopyroxene: Pyroxene mit orthorhombischer Symmetrie
Bildung und Fundorte
Pyroxene kommen sowohl massiv, in gekörnter Form als auch als meist dunkle, kurze, prismenförmige Kristalle vor. Als gesteinsbildende Minerale finden sie sich häufig in quarzarmen magmatischen Gesteinen wie Basalt, Gabbro und Pyroxenit. Kalziumreiche Klinopyroxene sind daneben auch in metamorphosiertem Kalkstein (=Skarn) enthalten, während in Steinmeteoriten in erster Linie Orthopyroxene, also kalziumarme Pyroxene, vorkommen. Im südlichen Hochland des Mars lassen die Ergebnisse der spektroskopischen Untersuchungen auf das Vorkommen von Pyroxen und Olivin schließen, die vulkanischen Gesteinen entstammen.[6]
Kristallstruktur
Die Variationsbreite der chemischen Zusammensetzung der Pyroxene findet ihre Erklärung in ihrer Kristallstruktur. Sie weist Kationenpositionen von sehr unterschiedlicher Größe und Form auf und bietet so einer Vielzahl von Kationen unterschiedlichster Größe und Ladung Platz. Auf allen diesen Kationenpositionen sind die Kationen von Sauerstoffanionen umgeben. Die verschiedenen Positionen unterscheiden sich in der Anzahl der umgebenden Anionen (Koordinationszahl), deren Abstand zum Kation und Anordnung um das Kation herum. Generell gilt: Je mehr Anionen ein Kation umgeben, desto größer wird der mittlere Abstand von der Kationenposition zu den Anionen, desto schwächer werden die einzelnen Bindungen und desto größer wird der ionische Charakter der Bindungen.
Die Pyroxenstruktur weist Kationenpositionen mit 3 verschiedenen Koordinationszahlen auf.
- Tetraederpositionen (T): 4 Sauerstoffionen (O2−) umgeben ein Kation tetraederförmig. Diese Position bietet kleinen Kationen mit zumeist hoher Ladung Platz (Si4+, Ti4+, Al3+). Die kurzen Kation-Anion-Bindungen haben einen hohen kovalenten Anteil (Atombindungen). Atombindungen sind stark gerichtet. Daher muss die Geometrie der bindenden Atomorbitale möglichst gut mit der Anordnung der umgebenden Anionen übereinstimmen. Erfüllt wird diese geometrische Randbedingung z. B. von sp3-hybridisierten Kationen wie Si4+. In dieser Elektronenkonfiguration vereinigt sich das eine äußere s-Orbital mit den drei äußeren p-Orbitalen zu 4 tetraedrisch ausgerichteten sp3-Hybridorbitalen.
- Oktaederposition (M1): 6 Sauerstoffionen (O2−) umgeben ein Kation oktaederförmig. Diese Position bietet mittelgroßen, zumeist zwei- und dreiwertigen Kationen Platz (Mg2+, Fe2+, Mn2+, Al3+, Fe3+). Die Bindungen sind vorwiegend ungerichtet ionisch.
- 6 bis 8-fach koordinierte Plätze (M2): 6–8 Sauerstoffionen (O2−) umgeben ein Kation. Diese Position bietet mittelgroßen bis großen ein bis zweiwertigen Kationen Platz (Mg2+, Fe2+ oder Na+, Ca2+). Die Bindungen sind schwach und vorwiegend ionisch. Kationen mittlerer Größe (Mg2+, Fe2+) sind 6-fach koordiniert, größere (Na+, Ca2+) 8-fach.
Die nebenstehenden Strukturabbildungen zeigen der Klarheit wegen nur die Flächen dieser Koordinationspolyeder. Die Sauerstoffe und Kationen selbst sind nicht dargestellt. Die Sauerstoffanionen befinden sich auf den Ecken der Polyeder, die Kationen im Zentrum der Polyeder.
Silicat-Anionenkomplex
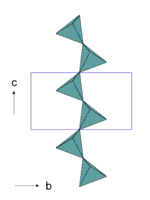
Das strukturelle Charakteristikum aller Pyroxene ist die Einfachkette aus SiO4-Tetraedern mit der Summenformel [Si2O6]4−. Hierin sind die SiO4-Tetraeder über zwei Sauerstoffe zu idealerweise unendlichen Ketten verbunden.
Nach der Silicatklassifikation von F. Liebau gehören die Pyroxene zur Gruppe der unverzweigten zweier Einfachketten-Silicate. Innerhalb einer Kette wiederholt sich die Orientierung der Silicattetraeder mit jedem zweiten Tetraeder (zweier Kette). Die Ketten sind untereinander nicht direkt miteinander verbunden (Einfachkette) und von der Kette zweigen keine weiteren Tetraeder ab (unverzweigt).
Die SiO4-Tetraeder sind in den Ketten so angeordnet, dass alle Tetraeder einer Kette mit einer Tetraederspitze in die gleiche Richtung weisen. Entsprechend weisen alle Tetraeder mit einer Fläche in die entgegensetzte Richtung. Die nebenstehende Abbildung zeigt einen Ausschnitt einer SiO4-Zweier-Einfachkette mit Blick auf die Tetraederspitzen.
Oktaederkette
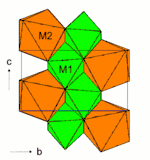
Auf der M1-Position werden die kleineren Kationen (vorwiegend Mg2+, Fe2+, Mn2+, Al3+) von sechs Sauerstoffen oktaedrisch koordiniert. Die Oktaeder sind über gemeinsame Kanten zu zickzackförmigen Ketten verknüpft.
Die M2-Koordinationspolyeder sind über drei gemeinsame Kannten mit drei M1-Oktaedern einer Kette verbunden. Im Falle von 8-fach koordinierten größeren Kationen auf M2, wie z. B. Ca2+ im Diopsid oder Hedenbergid, sind die Polyeder über eine gemeinsame Kannte mit den M2-Polyedern einer benachbarten Oktaederkette verbunden. Bei kleineren sechsfach koordinierten Kationen auf M2, wie z. B. Mg2+ im Enstatit, besteht eine solche Verknüpfung nicht.
I-Beams
Je zwei Tetraederketten sind über ihre freien Spitzen mit der Ober- bzw. Unterseite eines Oktaederbandes verbunden. Diese sandwichartige Baueinheit wird wegen ihres an den Großbuchstaben I erinnernden Querschnitts auch als I-Beam bezeichnet.
Diese I-Beams sind untereinander über die SiO4-Tetraeder und M2-Oktaeder verbunden.
Klino- und Orthopyroxene
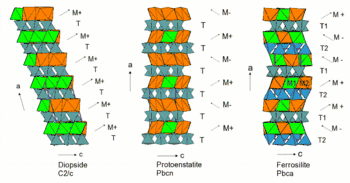
Die Pyroxene werden nach ihrer Symmetrie in zwei Gruppen eingeteilt:
- Klinopyroxene: Pyroxene mit monokliner Symmetrie (Raumgruppe C2/c). Hierzu zählen z. B. alle Na- und Ca-Pyroxene
- Orthopyroxene: Pyroxene mit orthorhombischer Symmetrie (Raumgruppen Pbca, Pbcn). Hierzu gehören z. B. die Pyroxene der Enstatit-Ferrosilit-Reihe (Raumgruppe Pbca) und z. B. die Hochtemperaturform des Enstatits (Protoenstatit, Raumgruppe Pbcn).
Die Pyroxenstrukturen der verschiedenen Raumgruppen unterscheiden sich in der Stapelung der Oktaederlagen in Richtung der kristallographischen a-Achse (siehe Abbildung).
Bei den Klinopyroxenen weisen alle Oktaeder die gleiche Orientierung auf. In a-Richtung aufeinanderfolgende Tetraeder- und Oktaederlagen sind in c-Richtung jeweils etwas zueinander versetzt. Aus diesem Versatz resultiert bei den Pyroxenen der schiefe Winkel der monoklinen Symmetrie.
Bei den Orthopyroxenen wechselt sich die Orientierung der Oktaeder periodisch in a-Richtung ab. Der Versatz der in a-Richtungen aufeinanderfolgenden Schichten wird hierbei ausgeglichen und es ergibt sich eine orthorhombische Elementarzelle.
Die Diagonale von einer Oktaederecke durch das Oktaederzentrum zur gegenüberliegenden Ecke weist abwechselnd in Richtung der a- und c-Achse (Lagen M+) und entgegen der Richtung der a- und c-Achsen (Lagen M−). Die Oktaederlagen gegensätzlicher Orientierung können durch Spiegelung an einer Spiegelebene (parallel zur b- und c-Achse) aufeinander abgebildet werden. Diese Verhältnisse gleichen auf Elementarzellebene denen der gängigen makroskopischen Zwillingsbildung bei Pyroxenen. Daher beschreibt man Orthopyroxenen auch als polysynthetische Verzwillingung auf Elementarzellebene.
Die Orthopyroxene der verschiedenen Raumgruppen Pbca und Pbcn unterscheiden sich in der Periodizität der Umkehrung der Oktaederorientierung. Pbca-Pyroxene (z. B. Ferrosollit) weisen eine Periodizität von zwei auf, d. h. nach jeder zweiten Oktaederschicht ändert sich die Orientierung der Oktaeder (Abfolge der Oktaederlagen M− M− M+ M+ M− M− …). Pbcn-Pyroxene zeichnen sich durch eine Umkehrung der Oktaederorientierung nach jeder Lage aus (Abfolge der Oktaederlagen M− M+ M− M+ M− …).
Verwendung
Einige Pyroxene eignen sich als Schmuckstein, so der grüne Enstatit, der ebenfalls grüne Diopsid und der rotbraune Hypersthen.
Der meist massiv auftretende Jadeit wurde wegen seiner sehr kompakten Struktur zur Herstellung von Axtklingen genutzt; daneben können aus Jadeit sehr fein geschnitzte Schmuckobjekte hergestellt werden.
Siehe auch
Literatur
- M. Cameron, J.J. Papike: Crystal Chemestry of Silicate Pyroxenes (1980), in Reviews in Mineralogy Vol. 7 pp. 5 – 87; Mineralogical Society of America
- Edition Dörfler: Mineralien Enzyklopädie, Nebel Verlag, ISBN 3-89555-076-0
- Martin Okrusch, Siegfried Matthes: Mineralogie. 7. Auflage. Springer Verlag, Berlin 2005, ISBN 3-540-23812-3
- Stefan Weiß: Das große Lapis Mineralienverzeichnis. 4. Auflage. Christian Weise Verlag, München 2002, ISBN 3-921656-17-6
Weblinks
Einzelnachweise
- Subcommite on Pyroxenes, CNMMN; Nobuo Morimoto: Nomenclature of Pyroxenes. In: The Canadian Mineralogist. Band 27, 1989, S. 143–156 (mineralogicalassociation.ca [PDF; 1,6 MB; abgerufen am 30. März 2019]).
- F. C. Hawthorne: The Use Of End-Member Charge-Arrangements In Defining New Mineral Species And Heterovalent Substitutions In Complex Minerals. In: The Canadian Mineralogist. 40, 2002, S. 699–710. (PDF (309 kB))
- Huifang Xu, Tina R. Hill, Hiromi Konishi, Gabriela Farfan: Protoenstatite: A new mineral in Oregon sunstones with “watermelon” colors. In: American Mineralogist. Band 102, 2017, S. 2146–2149 (minsocam.org [PDF; 1,1 MB; abgerufen am 18. Mai 2019]).
- Richard O. Sack, Mark S. Ghiorso: Thermodynamics of multicomponent pyroxenes: III. Calibration of Fe2+(Mg)-1, TiAl2(MgSi2)-1, TiFe3+2 (MgSi2)-1, AlFe3+(MgSi)-1, NaAI(CaMg)-1, Al2(MgSi)-1 and Ca(Mg)-1 exchange reactions between pyroxenes and silicate melts. In: Contributions to Mineralogy Petrology. Band 118, 1994, S. 271–296 (springer.com [PDF; 253 kB; abgerufen am 6. Januar 2018] preview).
- C. A. Goodrich & G. E. Harlow: Knorringite-Uvarovite Garnet and Cr-Eskola Pyroxene in Ureilite LEW 88774. In: Meteoritics & Planetary Science. 36, Supplement, 2002, S. A68, bibcode:2001M&PSA..36R..68G.
- Die feuchte Phase des Mars war global. In: www.raumfahrer.net. Raumfahrer Net e.V., abgerufen am 19. September 2019.