Phosphorsäurebrennstoffzelle
Die Phosphorsäurebrennstoffzelle (engl. Phosphoric Acid Fuel Cell, PAFC) ist eine Mitteltemperatur-Brennstoffzelle.
Prinzip
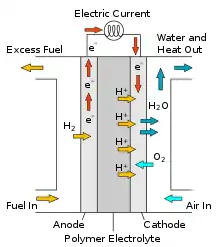
Die PAFC unterscheidet sich von anderen Brennstoffzellen dadurch, dass sie mit Phosphorsäure als Elektrolyt arbeitet. Die hochkonzentrierte Phosphorsäure (90 –100 %) ist in einer PTFE-Faserstruktur fixiert. Wie alle Brennstoffzellen produziert sie Strom durch die Oxidation eines Brenngases. Als Brenngas dient Wasserstoff. Als Oxidationsmittel kann Luft oder reiner Sauerstoff eingesetzt werden. Es müssen keine Reingase verwendet werden. Spuren von Kohlendioxid in den Gasen stellen bei der PAFC im Gegensatz zur AFC kein Problem dar. Die Phosphorsäurebrennstoffzelle arbeitet in einem Temperaturbereich von 160 bis 220 °C.[1]
Aufgrund der Temperatur und des Einsatzes von Phosphorsäure gelten hohe Anforderungen an die Qualität und die Widerstandskraft der Bauteile. In der Regel werden Kohlenstoff- und Graphitteile für die Elektroden benutzt. Der Vorteil dieses Typs ist, dass er verhältnismäßig unempfindlich gegen Verunreinigung des Brenngases ist.
Als Elektrolyt wird Phosphorsäure H3PO4 verwendet. Ein besonderer Vorteil der Phosphorsäure ist der niedrige Dampfdruck, welcher jedoch nicht ignoriert werden kann, d. h. flüssige Phosphorsäure verdampft dennoch langsam. Deshalb wird das Abgas normalerweise in einer Kühlzone auf 160 – 180 °C und somit auf rund 30 °C unter Betriebstemperatur abgekühlt. Somit kondensiert der Elektrolyt, bevor er aus der Zelle austritt und kann wieder zurück geleitet werden. Die Phosphorsäure ist in eine Matrix aus Siliciumcarbid eingepresst, die zwischen Anode und Kathode angebracht ist und durch die die Protonen wandern.
Als Katalysator wird meist Platin oder eine Platinlegierung verwendet, da diese in heißer Phosphorsäure H3PO4 stabil sind, katalytische Eigenschaften haben und in ausreichender Menge auf der Erde vorhanden sind, um sie industriell für den Elektrodenbau einzusetzen. In neueren Entwicklungen wurde z. B. ein Platin-Ruthenium-Gemisch als Katalysator eingesetzt, womit die Kohlenmonoxidtoleranz der Elektrode erhöht wurde. Heutzutage braucht man rund 0,25 mg Platin pro cm² für die Anode und 0,5 mg Platin pro cm² für die Kathode.
Verschiedene Kühlungsmethoden umfassen Flüssigkeitskühlung, Luftkühlung und Wasserkühlung, wobei die Wasserkühlung die am weitesten verbreitete ist. Die Wasserkühlung unterscheidet sich prinzipiell wieder in zwei Arten. Bei beiden Arten wird das Wasser in flüssiger Form in das Kühlsystem eingeführt. Bei der einen tritt das Wasser wieder flüssig aus, was jedoch große Mengen an Wasser benötigt, da nur ein geringer Anteil an Wärme aufgenommen werden kann. Bei der anderen tritt Wasser in zwei Phasen (flüssig/gasförmig) aus dem Kühlsystem aus, wodurch zwar ein höherer Aufwand bei der Konstruktion des Kühlsystems entsteht, dafür weniger Wasser zum Kühlen benötigt wird.
Reaktionsgleichungen
| Gleichung | |
|---|---|
| Anode | Oxidation / Elektronenabgabe |
| Kathode | Reduktion / Elektronenaufnahme |
| Gesamtreaktion | Redoxreaktion / Zellreaktion |
Der Brennstoff einer PAFC ist Wasserstoff bzw. wasserstoffreiches Gas. Wasserstoff wird zur Anode geleitet, an der die elektrochemische Reaktion stattfindet. Wasserstoff wird zu Wasserstoffionen (H+) oxidiert, die Elektronen (e−) werden von einer Sammelelektrode eingefangen und über einen Verbraucher zur Kathode geleitet. Die Protonen wandern durch den Elektrolyt von der Anode zur Kathode. An der Kathode wird Sauerstoff zugeführt, es kommt zu einer elektrochemischen Reaktion zwischen Sauerstoff, Wasserstoffionen und Elektronen; dabei entsteht Wasser und Wärme.
Vor- und Nachteile gegenüber anderen Brennstoffzellen
Vorteile einer PAFC sind:
- Robust
- Erhöhte Toleranz gegenüber Verschmutzungen des Brenngases
- Auf der Kathodenseite kann Luft verwendet werden (kein Reingas erforderlich)
- Gutes dynamisches Verhalten
- CO2-tolerant
Nachteile sind:
- Geringe Leistungsdichte
- Niedrige Lebensdauer (bedingt durch den äußerst aggressiven Elektrolyten)
- CO ist ein Katalysatorgift, die Toleranz gegenüber Kohlenmonoxid liegt zwischen (1–3 %) nimmt mit steigender Betriebstemperatur zu.
- Anlagenwirkungsgrad eher niedrig
SAFC
Bei den Feststoff-Säure Brennstoffzellen (engl.: Solid acid fuel cell, SAFC) bilden feste Phosphatsalze den Elektrolyten. Oberhalb 220 °C liegt die Protonenleitfähigkeit über von 0.05 (Ωcm)−1 und erreicht fast die Werte von PEFC (um 0.1 (Ωcm)−1). Die Salzbildung von Phosphorsäure wird durch die Zugabe von Alkaliphosphaten eingeleitet:
- Cs3PO4 + 2 H3PO4 → 3 CsH2PO4
Seit etwa 2010 wird untersucht, SAFC mit Wasserstoff zu betreiben, das durch Reformation aus Benzin gewonnen wird.[1][2] Die Technologie gilt auf lange Sicht als vielversprechend.[3]
Einzelnachweise
- Peter Kurzweil, Ottmar Schmid: Brennstoffzellentechnik: Grundlagen, Komponenten, Systeme, Anwendungen. 3. Auflage. Springer Fachmedien, Wiesbaden 2016, ISBN 978-3-658-14935-2, Kapitel 6: Phosphorsaure Brennstoffzelle (PAFC), S. 163–178, doi:10.1007/978-3-658-14935-2_6 (eingeschränkte Vorschau in der Google-Buchsuche).
- Kevin Bullis: Brennstoffzelle läuft mit Diesel. In: Technology Review. 27. Oktober 2010, abgerufen am 25. Februar 2017.
- Messstation für Brennstoffzellen: Brennstoffzellen wirtschaftlicher machen. Produktmeldung. In: Qualität und Zuverlässigkeit. 4. Mai 2018, abgerufen am 23. Juni 2021.