Ortoleva-King-Reaktion
Die Ortoleva-King-Reaktion ist eine Namensreaktion der organischen Chemie, deren Entdeckung auf Giovanni Ortoleva im Jahre 1899 zurückzuführen ist und 1944 von L. Carroll King aufgegriffen und weiter untersucht wurde. Mit Hilfe dieser Synthese lassen sich nützliche Pyridiniumiodid-Salze herstellen.[1]
Übersichtsreaktion
Bei der Ortoleva-King-Reaktion reagiert die funktionelle Methyl- oder Methylengruppe eines organischen Stoffes 1 mit Iod und zwei Äquivalenten Pyridin 2 mit Hilfe von Hitze zum korrespondierenden Pyridiniumiodid 3 und dem Pyridiniumhydroiodid-Salz 4. Bei den organische Resten R1 und R2 in 1 ist mindestens einer elektronenziehend. Diese sind für die Aktivierung der Methylengruppe verantwortlich und sorgen dafür, dass die Kohlenstoff-Wasserstoff-Bindung dieser Methylengruppe acide ist.[1][2]

Allgemein
Statt dem Pyridin, das nicht nur ein Edukt, sondern auch das Lösungsmittel bei dieser Reaktion ist, können auch Chinoline, Isochinoline, Picoline und Nicotinamide genutzt werden. Die Reaktion findet unter Einwirkung von Hitze statt.[3]
Reaktionsmechanismus
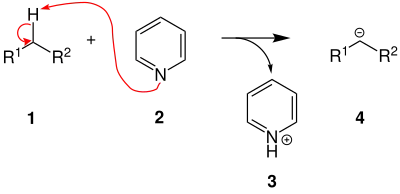
Der Reaktionsmechanismus der Reaktion könnte wie folgt aussehen. Im ersten Schritt wird die CH-acide Methylengruppe des Moleküls 1 durch Pyridin 2 deprotoniert. Es entstehen das Pyridiniumion 3, sowie das Anion 4.
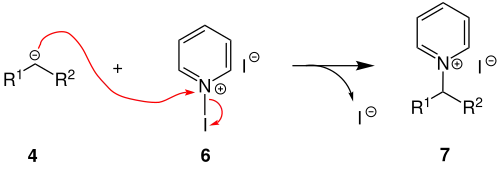
Durch Aktivierung eines zweiten Äquivalents Pyridin 2 durch Iod 5 entsteht das Intermediat 6.

Das Intermediat 6 wird nukleophil durch das Anion 4 angegriffen. Es entsteht das Pyridiniumiodid 7.
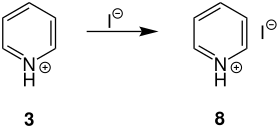
Durch die Rekombination des Pyridiniumion 3 mit dem Iodid entsteht das Pyridiniumhydroiodid-Salz 8 als Nebenprodukt.[1]
Anwendung
Mit Hilfe dieser Methode können viele verschiedene Pyridiniumiodid-Salze gewonnen werden. Die Ausbeute hierbei ist stark von dem genutzten Ausgangsstoff abhängig, aber ist generell sehr groß. Ein Problem bei dieser Reaktion ist das Trennen der Produkte, wodurch mit Einbußen bei der Ausbeute gerechnet werden muss. Auch heute findet die Ortoleva-King-Reaktion noch in verschiedenen Syntheseprozessen Anwendung.[4]
Einzelnachweise
- Jie Jack Li: Name Reactions in Heterocyclic Chemistry II. In: Wiley Series on Comprehensive Name Reactions. 6. Auflage. John Wiley & Sons, Inc., New Jersey 2011, ISBN 978-1-118-09282-8, S. 645–650, doi:10.1002/9781118092828.
- L. Carroll King: The Reactions of Iodine with Some Ketones in the Presence of Pyridine. In: Journal of the American Chemical Society. Band 66, Nr. 6, 1944, S. 894–895, doi:10.1021/ja01234a015.
- L. Carroll King, Margaret Mcwhirter: The Reactions of Acetophenone and Iodine with Some Nitrogenous Bases 1. In: Journal of the American Chemical Society. Band 68, Nr. 4, April 1946, S. 717–717, doi:10.1021/ja01208a504.
- Anton J. Stasyuk, Marzena Banasiewicz, Michał K. Cyrański, Daniel T. Gryko: Imidazo[1,2-a]pyridines Susceptible to Excited State Intramolecular Proton Transfer: One-Pot Synthesis via an Ortoleva–King Reaction. In: The Journal of Organic Chemistry. Band 77, Nr. 13, 2012, S. 5552–5558, doi:10.1021/jo300643w.