Natriumtellurit
Natriumtellurit ist eine anorganische chemische Verbindung des Natriums aus der Gruppe der Tellurite.
| Kristallstruktur | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
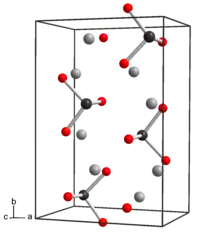 | ||||||||||||||||
| _ Na+ _ Te4+ _ O2− | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Natriumtellurit | |||||||||||||||
| Andere Namen |
Natriumtellurat(IV) | |||||||||||||||
| Verhältnisformel | Na2TeO3 | |||||||||||||||
| Kurzbeschreibung |
weißer Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 221,58 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest[1] | |||||||||||||||
| Löslichkeit |
löslich in Wasser[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Gewinnung und Darstellung
Natriumtellurit kann durch Reaktion von Tellurdioxid mit Natriumcarbonat unter einer Schutzatmosphäre wie Kohlendioxid gewonnen werden.[3]
Es wird auch aus Kupfertellurid oder Silbertellurid gewonnen, welche bei der elektrolytischen Gewinnung von Kupfer aus Erzen anfallen. Es dient so als Zwischenprodukt zur Herstellung von Tellur.[4]
Eigenschaften
Natriumtellurit ist ein weißer Feststoff, der löslich in Wasser ist.[1] Die Lösung wird durch Kohlendioxid aus der Luft unter Abscheidung von Tellurdioxid zersetzt. Natriumtellurit geht beim Erhitzen an der Luft in Natriumtellurat über.[3]
Verwendung
Durch Reaktion einer Lösung von Calciumchlorid mit Natriumtellurit kann Calciumtellurit gewonnen werden.[5]
Literatur
- S. L. Tagg, J. C. Huffman, J. W. Zwanziger: Crystal Structure and Sodium Environments in Sodium Tetratellurite, Na2Te4O9, and Sodium Tellurite, Na2TeO3, by X-ray Crystallography and Sodium-23 NMR. In: Chemistry of Materials. 6, 1994, S. 1884–1889, doi:10.1021/cm00046a052
Einzelnachweise
- Datenblatt Sodium tellurite(IV), 99.5% (metals basis) bei AlfaAesar, abgerufen am 21. Dezember 2013 (PDF) (JavaScript erforderlich).
- S. Gangolli, Royal Society of Chemistry (Great Britain): The Dictionary of Substances and Their Effects: O-S. Royal Society of Chemistry, 1999, ISBN 0-85404-833-2, S. 847 (eingeschränkte Vorschau in der Google-Buchsuche).
- Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band I, Ferdinand Enke, Stuttgart 1975, ISBN 3-432-02328-6, S. 437.
- George K. Schweitzer Distinguished Professor of Chemistry University of Tennessee, Lester L. Pesterfield Professor of Chemistry Western Kentucky University: The Aqueous Chemistry of the Elements. Oxford University Press, 2009, ISBN 0-19-974219-7, S. 238 (eingeschränkte Vorschau in der Google-Buchsuche).
- Richard C. Ropp: Encyclopedia of the Alkaline Earth Compounds. Newnes, 2012, ISBN 0-444-59553-8, S. 106 (eingeschränkte Vorschau in der Google-Buchsuche).
