Myotoxin
Myotoxin (aus altgriech. μῦς mys, Gen. μυός myos ‚Muskel‘ und τοξίνη, altgriechisch ausgesprochen toxíne ‚die giftige Substanz‘, zusammengenommen Muskelgift) ist ein Schlangengift-Peptid mit muskellähmender und -zerstörender Funktion. Speziell im Gift der Klapperschlangen (Crotalus) findet man verschiedene, homologe Peptide, die diese Funktion aufweisen.
Geschichte
a.jpg.webp)
Der brasilianische Wissenschaftler José Moura Gonçalves reinigte und identifizierte in den 1950er Jahren das erste Myotoxin, Crotamin, aus dem Gift der Schauer-Klapperschlange (Crotalus durissus terrificus), einer tropischen Klapperschlange, die in Südamerika heimisch ist.
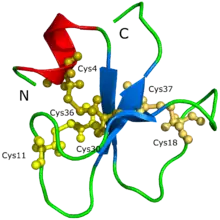
Struktur und Funktion
Strukturell sehr ähnliche Myotoxine – alle sind kleine, basische Peptide mit Molekülmassen um 4,5 kDa, isoelektrischen Punkten (pI) um 9,8 und strukturstabilisiert durch drei Disulfidbrücken – liegen im Gift von Grubenottern und Vipern vor.[2][3] Die Myotoxine führen beim Beutetier zu einer Muskellähmung (Myotoxizität) und verhindern die Flucht. Innerhalb von Minuten tritt dann der Tod durch Lähmung der Bauchatmung ein sowie durch einen weiteren nicht-enzymatischen Mechanismus, der zum lokalen Absterben des Muskelgewebes (Myonekrose) führt.
Sequenzhomologie
Myotoxine aus verschiedenen Schlangengiften sind vor allem in den 1960er bis 1980er Jahren isoliert und charakterisiert worden. Der Vergleich ihrer Aminosäuresequenzen zeigt einen hohen Grad an Sequenzhomologie und den auch in den Abständen konservativen Erhalt der drei Cystine (sechs Cysteine, die drei Disulfidbrücken bilden: Cys4-Cys36, Cys11-Cys30 und Cys18-Cys37[4]), die die Struktur des Myosinmoleküls stabilisieren (gelb: Cystein; grün: konservativ homologe (identische) Aminosäuresequenz):
Bezeichnung | Aminosäuresequenz (Einbuchstabencode) | Spezies (Crotalus) |
|---|---|---|
| Crotamin[5] | YKQCHKKGGHCFPKEKICLPPSSDFGKMDCRWRWKCCKKGSG | C. durissus terrificus |
| Myotoxin I[6] | YKRCHKKEGHCFPKTVICLPPSSDFGKMDCRWKWKCCKKGSVN | C. viridis concolor |
| Myotoxin II[6] | YKRCHKKGGHCFPKEKICTPPSSDFGKMDCRWKWKCCKKGSVN | C. viridis concolor |
| Myotoxin II m.[6] | YKRCHKKGGHCFPKTVICLPPSSDFGKMDCRWRWKCCKKGSVN | C. viridis concolor |
| Peptid c[7] | YKRCHKKGGHCFPKTVICLPPSSDFGKMDCRWKWKCCKKSVN | C. viridis helleri |
| Myotoxin a[8] | YKQCHKKGGHCFPKEKICIPPSSDLGKMDCRWKWKCCKKGSG | C. viridis viridis |
| CAM[9] | YKRCHKKGGHCFPKTVICLPPSSDFGKMDCRWRWKCCKKGSVNN | C. adamanteus |
Einzelnachweise
- G. Nicastro, L. Franzoni, C. de Chiara, A. C. Mancin, J. R. Giglio, A. Spisni Solution structure of crotamine, a Na+ channel affecting toxin from Crotalus durissus terrificus venom (PDF; 472 kB), In: Eur J Biochem 270 (9), S. 1969–1979 (2003). PMID 12709056.
- P. R. Griffin, S. D. Aird A new small myotoxin from the venom of the prairie rattlesnake (Crotalus viridis viridis). In: FEBS Lett., Vol. 274, S. 43–47 (1990). PMID 2253781.
- Y. Samejima, Y. Aoki, D. Mebs Amino acid sequence of a myotoxin from venom of the eastern diamondback rattlesnake (Crotalus adamanteus). In: Toxicon, Vol. 29, S. 461–468 (1991). PMID 1862521.
- V. Fadel, P. Bettendorff, T. Herrmann, W. F. de Azevedo Jr., E. B. Oliveira, T. Yamane und K. Wüthrich Automated NMR structure determination and disulfide bond identification of the myotoxin crotamine from Crotalus durissus terrificus. In: Toxicon (2005) 1;46(7):759–767. PMID 16185738.
- J. C. Laure Die Primärstruktur des Crotamins. In: Hoppe Seylers Z Physiol Chem (1975), Band 246, S. 799–803. doi:10.1515/bchm2.1975.356.1.213
- A. L. Bieber, R. H. McParland und R. R. Becker Amino acid sequences of myotoxins from „Crotalus viridis concolor“ venom. In: Toxicon (1987), Band 25, S. 677–680. PMID 3629618.
- N. Maeda und N. Tamiya Some chemical properties of the venom of the rattlesnake, „Crotalus viridis helleri“. In: Toxicon (1978), Band 16, S. 431–441. PMID 694946.
- J. W. Fox, M. Elzinga und A. T. Tu Amino acid sequence and disulfide bond assignment of myotoxin a isolated from the venom of prairie rattlesnake („Crotalus viridis viridis“). In: Biochemistry (1979), Band 18, S. 678–684. PMID 570412.
- Y. Samejima, Y. Aoki und D. Mebs Structural studies on a myotoxin from „Crotalus adamanteus“ venom in Progress in Venom and Toxin Research (1988), S. 186–187, P. Gopalakkrishnakone und C. K. Tan (Hrsg.), Natl. Univ. Singapore Press, Singapore.
Literatur
- Alan L. Harvey (Hrsg.): Snake Toxins, International Encyclopedia of Pharmacology and Therapeutics, Sect. 134, Pergamon Press, New York, Oxford, Beijing, Frankfurt, São Paulo, Sydney, Tokyo, Toronto 1991, S. 70–71 (allgemein), S. 118–119 (Mechanismus), S. 120–121 (Struktur/Aktivität); S. 394–395 (Klonierung); S. 435 (Sequenzen).