Kaliumhexafluoronickelat(IV)
Kaliumhexafluoronickelat(IV) ist eine anorganische chemische Verbindung aus der Gruppe der Kaliumfluorkomplexe.
| Kristallstruktur | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
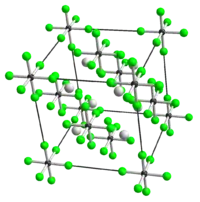 | |||||||||||||
| _ K+ _ Ni4+ _ F− | |||||||||||||
| Allgemeines | |||||||||||||
| Name | Kaliumhexafluoronickelat(IV) | ||||||||||||
| Andere Namen |
| ||||||||||||
| Verhältnisformel | K2[NiF6] | ||||||||||||
| Kurzbeschreibung |
roter Feststoff[1] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 250,88 g·mol−1 | ||||||||||||
| Aggregatzustand |
fest[2] | ||||||||||||
| Dichte |
3,03 g·cm−3[1] | ||||||||||||
| Löslichkeit |
reagiert mit Wasser[1] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Gewinnung und Darstellung
Kaliumhexafluoronickelat(IV) kann durch Reaktion von Kaliumchlorid mit Nickel(II)-chlorid und Fluor bei 275 °C gewonnen werden.[1]
Eigenschaften
Kaliumhexafluoronickelat(IV) ist ein diamagnetisches[3] leuchtend rotes Salz, das mit Wasser unter Gasentwicklung und Bildung eines schwarzen Niederschlages reagiert. Er wird von Wasserstoff bei 200 °C reduziert und besitzt eine Kristallstruktur vom Kaliumhexachloroplatinat(IV)-Typ mit einem Gitterparameter von a = 8,109 Å.[2][4]
Verwendung
Kaliumhexafluoronickelat(IV) wird als Ausgangsstoff zur Herstellung der starken Oxidations- und Fluorierungsmittel Nickel(III)-fluorid und Nickel(IV)-fluorid verwendet.[2] Es wird in der organischen Chemie auch als Fluorierungsmittel eingesetzt.[5]
Einzelnachweise
- Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band I, Ferdinand Enke, Stuttgart 1975, ISBN 3-432-02328-6, S. 277.
- Datenblatt Potassium hexafluoronickelate(IV), 99% bei Sigma-Aldrich, abgerufen am 24. Oktober 2013 (PDF).
- J. H. Simons: Fluorine Chemistry. Elsevier, 2012, ISBN 0-323-14543-4, S. 31 (eingeschränkte Vorschau in der Google-Buchsuche).
- J.C. Taylor, P.W. Wilson: The structures of fluorides IV. In: Journal of Inorganic and Nuclear Chemistry. 36, 1974, S. 1561–1563, doi:10.1016/0022-1902(74)80623-8.
- T. Nakajima, B. Žemva, A. Tressaud: Advanced inorganic fluorides : synthesis, characterization, and applications. Elsevier, 2000, ISBN 0-08-052548-2, S. 108 (eingeschränkte Vorschau in der Google-Buchsuche).

