Infektiöser Tumor
Ein infektiöser Tumor (synonym klonaler transmissibler Tumor) ist ein Tumor, der durch Infektionswege übertragen werden kann. Sie unterscheiden sich von Tumoren, die durch Onkoviren oder karzinogene Bakterien ausgelöst werden (onkovirale und onkobakterielle Tumoren), durch das Fehlen ebendieser Erreger. Daher bilden die Tumorzellen aller Individuen der Infektionskette einen Klon.
Geschichte
Hunde
Bereits 1876 wurde das Sticker-Sarkom (synonym CTVT, von engl. canine transmissible venereal tumor ‚übertragbarer Geschlechtstumor des Hundes‘) bei Hunden durch M. A. Novinsky als infektiöser Tumor beschrieben.[1] Anton Sticker beschrieb 1906 diese Erkrankung eingehender. Die Entstehung des Sticker-Sarkoms wird auf zwischen 500 v. Chr. und 9300 v. Chr. geschätzt und ist somit die älteste existierende tierische Zelllinie.[2][3][4][5] Seit seiner Entstehung hat das Sticker-Sarkom etwa 1,9 Millionen Mutationen angesammelt, 646 Gene wurden deletiert.[4] Das Sticker-Sarkom wird sexuell und oral übertragen. Vor etwa 500 Jahren hat es sich global in Hundepopulationen ausgebreitet.[5][6][7][8]
Goldhamster
Der erste Nachweis des Fehlens eines anderen Tumor-auslösenden Pathogens in einem übertragenen Tumor erfolgte 1964 bei einem kontagiösen Retikulumzell-Sarkom aus einem syrischen Goldhamster.[9][10] Dieser Tumor konnte experimentell durch Stechmücken übertragen werden.
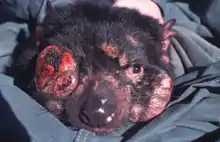
Beutelteufel
Im Jahr 1996 ist in Australien erstmals ein infektiöser Tumor des Beutelteufels (Tasmanischer Teufel) beschrieben worden, das Devil Facial Tumour Disease (DFTD oder DFT1).[11] Es wird vermutet, dass ein genetischer Flaschenhals oder eine geringe Variabilität der Haupthistokompatibilitätskomplexe bei den Beutelteufeln zu einer erleichterten Transmission beiträgt.[12] Dieser Tumor wird meistens durch Gesichtsbisse übertragen und stellt eine Bedrohung für die ohnehin bedrohte Tierart dar, weshalb bereits Umsiedelungsprogramme von Beutelteufeln auf isolierte Inseln und Zoos weltweit durchgeführt wurden. Analysen ergaben, dass sich die Tumorzellen wahrscheinlich aus Schwannschen Zellen entwickelt haben.[13] Diese vermehren sich normalerweise im Verletzungsfall für kurze Zeit als Teil des Heilungsprozesses. 2014 konnte beim Beutelteufel ein weiterer infektiöser Gesichtskrebs (DFT2) identifiziert werden, der sich von dem herkömmlichen DFT1 in der histologischen Struktur sowie in der Abstammungshistorie, im Chromosomenaufbau und Mutationsprofil deutlich unterscheidet.[14][15][16][17] DFT1 Infektionen konnten sich seit den späten 1990er Jahren über die meisten Gebiete Tasmaniens ausbreiten und werden für Beutelteufel-Populationseinbrüche um bis zu 80 % verantwortlich gemacht,[18][19] während sich die DFT2 Epidemie bisweilen vollständig auf die lokale Population der südöstlichen D'Entrecasteaux Channel Halbinsel beschränkt.[20]
Mensch
Beim gesunden Menschen sind nur Einzelfälle der Transmission von Tumoren beschrieben worden,[21] die jedoch keine Infektkette aufrechterhalten konnten, da sie nicht auf weitere Menschen übertragbar sind. Etwa 0,04 % der Empfänger eines Organtransplantates entwickeln unter der Immunsuppression Metastasen aus malignen Zellen des Spenders, meistens Melanome, und etwa 0,06 % der Empfänger von hämatopoetischen Stammzellen erwerben eine maligne hämatologische Erkrankung.[22] Etwa ein Drittel der Organempfänger, deren Spender einen diagnostizierten Tumor hatten, entwickelten die gleiche Erkrankung.[23] Diese Studien trennen jedoch nicht zwischen spontan durch Mutation entstandenen nicht-infektiösen Tumoren, infektiösen Tumoren, onkoviralen Tumoren und onkobakteriellen Tumoren. Weiterhin führen transplantierte Tumoren beim Menschen nicht zu einer fortlaufenden Infektkette.
Im Januar 2021 wurde zwei Fälle veröffentlicht, in denen Neugeborene in Japan möglicherweise mit Tumoren (Gebärmutterhalskrebs) ihrer Mutter vor oder während der Geburt infiziert wurden. Der genetische Fingerabdruck der kindlichen und mütterlichen Krebszellen zeigte übereinstimmende Mutationen; und den kindlichen Krebszellen fehlte das Y-Chromosom, obwohl es sich bei beiden um Jungen handelt. Zudem waren Tests auf Humane Papillomviren positiv.[24] Auch hier kam es nicht zu einer fortlaufenden Infektkette.
Muscheln
Eine Leukämie-artige infektiöse Neoplasie gehört zu den sechs schädlichsten Pathogenen der Muschel Mya arenaria.[25][26] 2016 wurden solche infektiösen Neoplasien auch in mehreren anderen Muschelfamilien beschrieben: in der Miesmuschel Mytilus trossulus, in der Herzmuschel Cerastoderma edule und in der Venusmuschel Polititapes aureus. Die Zelllinie in P. aureus stammt ursprünglich von einer anderen Venusmuschel, Venerupis corrugata.[27]
Weblinks
- Rettungsprogramm für Beutelteufel der australischen und tasmanischen Regierung. Abgerufen am 2. Dezember 2012.
- Astrid Viciano: Gefährliche Nähe. Auf SZ Online der Süddeutschen Zeitung vom 8. Juli 2018.
- Wenn sich Tiere mit Krebs anstecken, auf: spiegel.de vom 23. Juni 2016, Quelle:boj/dpa
- Nicole Paschek: Wenn Krebs ansteckend wird, auf: spektrum.de vom 18. Dezember 2018
Einzelnachweise
- M. A. Novinski: Zur Frage uber die Impfung der Krebsigen Geschwulste. In: Zentralbl Med Wissensch. (1876), Band 14, S. 790–791.
- C. Murgia, J. K. Pritchard, S. Y. Kim, A. Fassati, R. A. Weiss: Clonal origin and evolution of a transmissible cancer. In: Cell (2006), Band 126(3), S. 477–487. PMID 16901782, PMC 2593932 (freier Volltext).
- I. D. O’Neill: Concise review: transmissible animal tumors as models of the cancer stem-cell process. In: Stem Cells (2011), Band 29(12), S. 1909–1914. doi:10.1002/stem.751. PMID 21956952.
- Elizabeth P. Murchison, David C. Wedge, Ludmil B. Alexandrov, Beiyuan Fu, Inigo Martincorena, Zemin Ning, Jose M. C. Tubio, et al.: Transmissible Dog Cancer Genome Reveals the Origin and History of an Ancient Cell Lineage. In: Science. Band 343, Nr. 6169, 24. Januar 2014, ISSN 0036-8075, S. 437–440, doi:10.1126/science.1247167, PMID 24458646 (sciencemag.org).
- Adrian Baez-Ortega, Kevin Gori, Andrea Strakova, Janice L. Allen, Karen M. Allum, Leontine Bansse-Issa, Thinlay N. Bhutia, et al.: Somatic evolution and global expansion of an ancient transmissible cancer lineage. In: Science. Band 365, Nr. 6452, 2. August 2019, ISSN 0036-8075, doi:10.1126/science.aau9923, PMID 31371581 (sciencemag.org).
- Daniel Lingenhöhl: Wie Hundekrebs die Welt eroberte, auf: spektrum.de vom 2. August 2019
- Marin Vieweg: Skurril: Dem ansteckenden Hundekrebs auf der Spur, auf: wissenschaft.de vom 1. August 2019
- Fast spurlos verschwunden – Europäer brachten Amerikas Hunden den Tod, auf: n-tv.de/wissen vom 9. Juli 2018, Quelle: ntv.de, Walter Willems, dpa
- H. L. Copper, C. M. Mackay, W. G. Banfield: Chromosome studies of a contagious reticulum cell sarcoma of the syrian hamster. In: J Natl Cancer Inst. (1964), Band 33, S. 691–706. PMID 14220251.
- W. G. Banfield, P. A. Woke, C. M. Mackay, H. L. Cooper: Mosquito transmission of as reticulum cell sarcoma of hamsters. In: Science (1965), Band 148(3674), S. 1239–1240. PMID 14280009.
- A. M. Pearse, K. Swift: Allograft theory: transmission of devil facial-tumour disease. In: Nature (2006), Band 439(7076), S. 549. PMID 16452970.
- K. Belov: The role of the Major Histocompatibility Complex in the spread of contagious cancers. In: Mamm Genome. (2011), Band 22(1-2), S. 83–90. PMID 20963591.
- Elizabeth P. Murchison, Cesar Tovar, Arthur Hsu, Hannah S. Bender, Pouya Kheradpour, Clare A. Rebbeck, David Obendorf, et al.: The Tasmanian Devil Transcriptome Reveals Schwann Cell Origins of a Clonally Transmissible Cancer. In: Science. Band 327, Nr. 5961, 1. Januar 2010, ISSN 0036-8075, S. 84–87, doi:10.1126/science.1180616, PMID 20044575 (sciencemag.org).
- Ruth J. Pye, David Pemberton, Cesar Tovar, Jose M. C. Tubio, Karen A. Dun, Samantha Fox, Jocelyn Darby, et al.: A second transmissible cancer in Tasmanian devils. In: Proceedings of the National Academy of Sciences. Band 113, Nr. 2, 12. Januar 2016, ISSN 0027-8424, S. 374–379, doi:10.1073/pnas.1519691113, PMID 26711993 (pnas.org).
- Maximilian R. Stammnitz, Tim H. H. Coorens, Kevin C. Gori, Dane Hayes, Beiyuan Fu, Jinhong Wang, Daniel E. Martin-Herranz, et al.: The Origins and Vulnerabilities of Two Transmissible Cancers in Tasmanian Devils. In: Cancer Cell. Band 33, Nr. 4, 9. April 2018, ISSN 1535-6108, S. 607–619.e15, doi:10.1016/j.ccell.2018.03.013, PMID 29634948.
- Young Mi Kwon, Maximilian R. Stammnitz, Jinhong Wang, Kate Swift, Graeme W. Knowles, Ruth J. Pye, Alexandre Kreiss, et al.: Tasman-PCR: a genetic diagnostic assay for Tasmanian devil facial tumour diseases. In: Royal Society Open Science. Band 5, Nr. 10, S. 180870, doi:10.1098/rsos.180870, PMID 30473836, PMC 6227955 (freier Volltext) – (royalsocietypublishing.org).
- Alison Caldwell, Rachel Coleby, Cesar Tovar, Maximilian R. Stammnitz, Young Mi Kwon, Rachel S. Owen, Marios Tringides, et al.: The newly-arisen Devil facial tumour disease 2 (DFT2) reveals a mechanism for the emergence of a contagious cancer. In: eLife. Band 7, 14. August 2018, ISSN 2050-084X, S. e35314, doi:10.7554/eLife.35314 (elifesciences.org).
- Billie T. Lazenby, Mathias W. Tobler, William E. Brown, Clare E. Hawkins, Greg J. Hocking, Fiona Hume, Stewart Huxtable, et al.: Density trends and demographic signals uncover the long-term impact of transmissible cancer in Tasmanian devils. In: Journal of Applied Ecology. Band 55, Nr. 3, 2018, ISSN 1365-2664, S. 1368–1379, doi:10.1111/1365-2664.13088, PMID 30089931, PMC 6078421 (freier Volltext) – (wiley.com).
- Young Mi Kwon, Kevin C. Gori, Naomi Park, Nicole Potts, Kate Swift, Jinhong Wang, Maximilian R. Stammnitz, et al.: Evolution and lineage dynamics of a transmissible cancer in Tasmanian devils. In: PLOS Biology. Band 18, Nr. 11, 24. November 2020, ISSN 1545-7885, S. e3000926, doi:10.1371/journal.pbio.3000926, PMID 33232318, PMC 7685465 (freier Volltext) – (plos.org).
- Samantha James, Geordie Jennings, Young Mi Kwon, Maximilian R. Stammnitz, Alexandra Fraik, Andrew Storfer, Sebastien Comte, et al.: Tracing the rise of malignant cell lines: Distribution, epidemiology and evolutionary interactions of two transmissible cancers in Tasmanian devils. In: Evolutionary Applications. Band 12, Nr. 9, 2019, ISSN 1752-4571, S. 1772–1780, doi:10.1111/eva.12831, PMID 31548856, PMC 6752152 (freier Volltext) – (wiley.com).
- H. V. Gärtner, C. Seidl, C. Luckenbach, G. Schumm, E. Seifried, H. Ritter, B. Bültmann: Genetic analysis of a sarcoma accidentally transplanted from a patient to a surgeon. In: N Engl J Med., Band 335(20), 1996, S. 1494–1496. PMID 8890100. doi:10.1056/NEJM199611143352004.
- J. S. Welsh: Contagious cancer. In: Oncologist (2011), Band 16(1), S. 1–4. PMID 21212437; PMC 3228048 (freier Volltext).
- I. Penn: Tumors arising in organ transplant recipients. In: Adv Cancer Res. (1978), Band 28, S. 31–61. PMID 360796.
- Ayumu Arakawa et al.: Vaginal Transmission of Cancer from Mothers with Cervical Cancer to Infant, in: N Engl J Med 2021, Nr. 384, S. 42-50, 7. Januar 2021, doi:10.1056/NEJMoa2030391. Dazu:
- Donna Lu: Two children with cancer may have acquired tumour cells before birth, auf: NewScientist vom 6. Januar 2021.
- Peter Dockrill: Extremely Rare Phenomenon Sees Babies Inhale Cancer Cells During Vaginal Birth, auf: sciencealert vom 14. Januar 2021
- M. J. Metzger, C. Reinisch, J. Sherry, S. P. Goff: Horizontal transmission of clonal cancer cells causes leukemia in soft-shell clams. In: Cell. Band 161, Nummer 2, April 2015, ISSN 1097-4172, S. 255–263, doi:10.1016/j.cell.2015.02.042, PMID 25860608, PMC 4393529 (freier Volltext).
- N. G. Taraska, S. Anne Böttger: Selective initiation and transmission of disseminated neoplasia in the soft shell clam Mya arenaria dependent on natural disease prevalence and animal size. In: Journal of invertebrate pathology. Band 112, Nummer 1, Januar 2013, ISSN 1096-0805, S. 94–101, doi:10.1016/j.jip.2012.10.001, PMID 23079141.
- Michael J. Metzger et al.: Widespread transmission of independent cancer lineages within multiple bivalve species. Nature, 2016, doi:10.1038/nature18599.