Hydrophober Kollaps
Der hydrophobe Kollaps ist eine Hypothese zur Faltung von Proteinstrukturen aufgrund des hydrophoben Effekts.
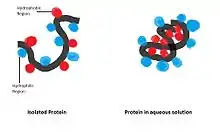
Eigenschaften
Der hydrophobe Kollaps beschreibt die Ausbildung der nativen Konformation eines Proteins in polaren Lösungsmitteln. Dies betrifft meistens wässrige Lösungsmittel, wie sie innerhalb einer Zelle oder im Extrazellularraum vorkommen. Die korrekte Faltung ist notwendig für Protein-Protein-Interaktionen und bei Enzymen für die Enzymaktivität. Der hydrophobe Kollaps kann durch einen Faltungstrichter dargestellt werden.
Die Kinetik der Proteinfaltung per hydrophobem Kollaps wurde für Myoglobin,[1] Barstar[2] und einer Nuclease aus Staphylococcus gezeigt.[3] Der hydrophobe Kollaps kann in silico durch Molekulardynamik,[4] Monte-Carlo-Simulation[5] und Φ-Analyse simuliert werden.[6]
Einzelnachweise
- M. Arai, K. Kuwajima: Rapid formation of a molten globule intermediate in refolding of alpha-lactalbumin. In: Folding & design. Band 1, Nummer 4, 1996, S. 275–287, PMID 9079390.
- V. R. Agashe, M. C. Shastry, J. B. Udgaonkar: Initial hydrophobic collapse in the folding of barstar. In: Nature. Band 377, Nummer 6551, Oktober 1995, S. 754–757, doi:10.1038/377754a0, PMID 7477269.
- G. J. Vidugiris, J. L. Markley, C. A. Royer: Evidence for a molten globule-like transition state in protein folding from determination of activation volumes. In: Biochemistry. Band 34, Nummer 15, April 1995, S. 4909–4912, PMID 7711012.
- N. J. Marianayagam, S. E. Jackson: The folding pathway of ubiquitin from all-atom molecular dynamics simulations. In: Biophysical chemistry. Band 111, Nummer 2, Oktober 2004, S. 159–171, doi:10.1016/j.bpc.2004.05.009, PMID 15381313.
- M. Brylinski, L. Konieczny, I. Roterman: Hydrophobic collapse in (in silico) protein folding. In: Computational Biology and Chemistry. Band 30, Nummer 4, August 2006, S. 255–267, doi:10.1016/j.compbiolchem.2006.04.007, PMID 16798094.
- E. Paci, C. T. Friel, K. Lindorff-Larsen, S. E. Radford, M. Karplus, M. Vendruscolo: Comparison of the transition state ensembles for folding of Im7 and Im9 determined using all-atom molecular dynamics simulations with phi value restraints. In: Proteins. Band 54, Nummer 3, Februar 2004, S. 513–525, doi:10.1002/prot.10595, PMID 14747999.