Hosomi-Sakurai-Reaktion
Die Sakurai-Reaktion (korrekter Hosomi-Sakurai-Reaktion genannt) ist die Reaktion einer elektrophilen Verbindung, etwa einer Carbonylverbindung, mit einem nucleophilen allylischen Silan, wobei ein substituierter β-Allylalkohol entsteht.[1] Die Reaktion ist mit der Grignard-Reaktion vergleichbar, läuft aber nur bei Anwesenheit starker Lewis-Säuren wie Titan(IV)-chlorid, Bor(III)-fluorid, Zinn(II)-chlorid oder AlCl(C2H5)2 als Katalysator ab.
Die Reaktion ist benannt nach den japanischen Chemikern Akira Hosomi und Hideki Sakurai, die sie 1976 erstmals publizierten.[1] Analog zur Grignard-Reaktion bestimmt der Typ der eingesetzten Carbonylverbindung, ob ein primärer (aus Formaldehyd, R1 = R2 = H), sekundärer (aus allen anderen Aldehyden, R1 = H, R2 = beliebiger Rest ≠ H) oder tertiärer (aus Ketonen, R1, R2 beliebige Reste ≠ H) Alkohol entsteht:
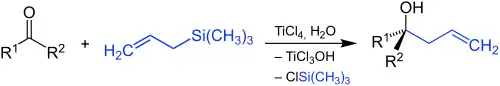
Auch Imine, Acetale, Epoxide und Carbonsäurehalogenide können eingesetzt werden.[2]
Bei α,β-ungesättigten Ketonen (R1 = z. B. Alkyl) erfolgt eine 1,4-Addition:

Mechanismus
Die Lewissäure steigert die Reaktivität des Elektrophils durch eine Erhöhung der positiven Partialladung. Dadurch wird die nucleophile Addition, die der geschwindigkeitsbestimmende Schritt ist, ermöglicht:[3]
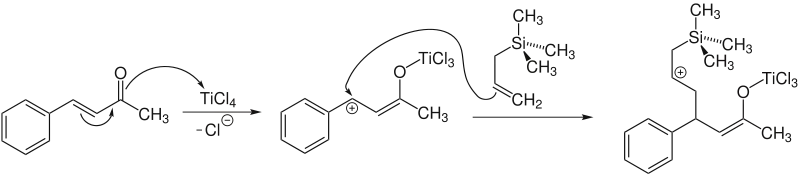
Die Trimethylsilylgruppe verhält sich nicht wie eine Lewissäure. Aus diesem Grund ist ein ringförmiger Übergangszustand auszuschließen. In Reaktionen von substituierten Allylen mit Aldehyden kann eine antiperiplanare Anordnung beim Übergangszustand angenommen werden:[4]

Einzelnachweise
- Akíra Hosomi, Hideki Sakurai: Syntheses of γ,δ-unsaturated alcohols from allylsilanes and carbonyl compounds in the presence of titanium tetrachloride. In: Tetrahedron Letters. Band 17, Nr. 16, April 1976, S. 1295–1298, doi:10.1016/S0040-4039(00)78044-0.
- Portal für Organische Chemie: Hosomi-Sakurai-Reaktion.
- Portal für Organische Chemie: Hosomi-Sakurai-Reaktion.
- Portal für Organische Chemie: Hosomi-Sakurai-Reaktion.